Епідеміологія раку шлунка
За останні 50 років захворюваність на рак шлунка в розвинених країнах має стійку тенденцію до зниження. Так, в США рак шлунка займає 13-е місце серед причин смерті від злоякісних пухлин: у 2003 р було зареєстровано 12 100 випадків смерті від раку цієї локалізації. Разом з тим, в країнах, що розвиваються рак шлунка продовжує займати 2-е місце серед причин смерті від онкологічних захворювань, поступаючись лише раку легенів. У Росії показники захворюваності одні з найвищих в світі, характеризуються значною регіональної варіабельністю. Найчастіше рак шлунка хворіють в Східному Сибіру, на Півночі Європейської частини Росії і на Далекому Сході, більш ніж в 2 рази рідше це захворювання зустрічається на півдні країни, особливо в північнокавказькому регіоні.
За літературними даними, чоловіки хворіють на рак шлунка в 1,7 рази частіше, ніж жінки, середній вік хворих становить 65 років (від 40 до 70 років). Зниження захворюваності на рак шлунка відбувається за рахунок дистальних локалізацій, обумовлених інфікуванням Helicobacter pylori. В останні роки частота проксимальних рак шлунка збільшилася, що може бути обумовлене збільшеними показниками захворюваності стравоходом Барретта.
Етіологія раку шлунка
Розвиток раку шлунка може бути обумовлено багатьма причинами, більш імовірна мультифакториальная його етіологія. Можна припустити, що розвиток злоякісної пухлини шлунка включає гістологічні зміни, що починаються від атрофії слизової оболонки шлунка з подальшим розвитком метаплазії, дисплазії і злоякісних змін.
Генетичні чинники відіграють важливу роль у виникненні раку шлунка . Приклади генетичного успадкування захворювання спостерігалися століттями, найбільш показовою в цьому плані є сім'я Бонапартов: Наполеон, його батько Чарльз, дід Джозеф, а також кілька нащадків Наполеона померли від раку шлунка. Пацієнти зі спадковим неполіпозним колоректальний
раком (синдром Лінча II), аутосомно-домінантним захворюванням з високим ступенем пенетрантности, мають вкрай високий ризик розвитку раку шлунка. Крім того, ризик розвитку захворювання у найближчих родичів хворих на рак шлунка в 2-3 рази вище. На користь генетичних факторів говорить і висока частота раку шлунка, в основному дифузного типу, у пацієнтів з групою крові А (П).
Проспективні клінічні дослідження показали, що інфікування Н. pylori призводить до 3-6-кратного збільшення частоти виникнення раку шлунка, в основному интестинального типу з локалізацією в дистальної третини шлунка. Разом з тим не вдалося довести роль виразки, зумовленої Н. pylori, у виникненні раку, отже, колонізація Н. pylori відіграє незалежну роль у розвитку цих двох форм патології.
В даний час доведено превалювання атрофічного гастриту і кишкової метаплазії серед популяцій людей в регіонах з більшою частотою виникнення раку шлунка. В 12-дефіцитна анемія призводить до триразового збільшення ризику розвитку раку, що, ймовірно, зумовлено тривалим зниженням кислотності шлункового соку, гипергастринемией і нейроендокринної гіперплазію.
Очевидна зворотний зв'язок між захворюваністю на рак шлунка і соціально-економічним статусом. Ймовірно, мають значення перенаселення, незадовільні санітарні умови, неадекватне консервування пиши. Тютюнопаління, деякі дієтичні фактори ризику (надмірне споживання солоної, копченої їжі, нестача в раціоні овочів і фруктів), надмірне вживання алкогольних напоїв, незадовільні умови зберігання харчових продуктів можуть сприяти виникненню раку шлунка. Дослідження, проведені в Японії, показали, що зниження захворюваності на рак шлунка відбувалося паралельно зі зниженням вживання солоної і сушеної їжі і збільшенням споживання свіжих овочів і фруктів. Їжа з високим вмістом нітритів і нітратів, які раніше використовувалися для зберігання м'яса, риби і овочів, індукує розвиток пухлини шлунка у тварин. Анаеробні бактерії, що колонізують атрофовану слизову оболонку шлунка, сприяють перетворенню нітритів і нітратів в TV-нитрозосоединения, що володіють канцерогенним ефектом. Використання охолодження харчових продуктів і вдосконалення методів їх консервації сприяло зменшенню захворюваності на рак шлунка. Збільшення вмісту в їжі вітаміну С може грати протективногороль.
Спірним є етіологічна роль у розвитку раку шлунка таких факторів, як доброякісні виразки шлунка, залізисті поліпи дна шлунка, гіперпластичні поліпи. Дистальна резекція шлунка асоціюється з високим ризиком (в 2-3 рази) розвитку раку шлунка. Захворювання при цьому виникає через 20-30 років після оперативного втручання — терміну, необхідного для розвитку кишкової метаплазії, дисплазії і раку під впливом тривалої ахлоргідрії і ентерогастрального рефлюксу після резекції шлунка.
Слід зазначити відмінності в етіології дистального і проксимального раку шлунка і необхідність проведення подальших епідеміологічних досліджень для з'ясування причин виникнення цих різних захворювань.
Патологічна анатомія і класифікація раку шлунка
Рак шлунка починає розвиватися на невеликій ділянці слизової оболонки, потім проростає товщу стінки органу. Крім того, пухлина росте і уздовж його стінки, але переважно в сторону кардії, що обумовлено особливостями лімфовідтоку. Макро- і мікроскопічна межі пухлини практично ніколи не збігаються. При екзофітної зростаючої пухлини злоякісні клітини визначаються на відстані 2-3 см від макроскопічно визначається межі пухлини, при інфільтративні і змішаної — на 5-6 см і більше.
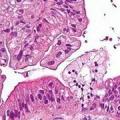
Основний гістологічної формою раку шлунка є аденокарцинома, яка становить близько 90 -95% усіх злоякісних пухлин шлунка. Другим найбільш частим злоякісним ураженням шлунка є лімфома. Дещо рідше зустрічаються Лейоміосаркома (2%), карциноид (1%), аденоакантома (1%) і плоскоклітинний рак (1%). Аденокарциноми шлунка класифікують в залежності від мікроскопічних критеріїв, що відображають ступінь злоякісності пухлини. В порядку зростання ступеня злоякісного потенціалу варіанти аденокарциноми можна розташувати в такий спосіб: тубулярная, папілярна, муцинозная і перстневидно-клітинна аденокарцинома.
Відповідно до альтернативної гістологічної класифікації раку шлунка, запропонованої Lauren в 1953 р, розрізняють :
1. Інтестинальний (епідемічний) тип раку шлунка, що характеризується експансивним ростом і збереженням залозистої структури, менш інвазивним ростом і наявністю чітких контурів пухлини, часто асоціюється з атрофічним гастритом. Інтестинальний тип рак шлунка по Lauren відповідає типу 1 або II раку шлунка по Borrmann, розвиток його пов'язано з впливом факторів навколишнього середовища, він володіє більш сприятливим прогнозом, спадковість не впливає на виникнення цього типу пухлини.
2. Дифузний, або інфільтративний, тип (ендемічний), що складається з кластерів низькодиференційованих клітин і характеризується відсутністю чітких контурів пухлини. Дифузний тип раку шлунка менш асоційований з впливом факторів навколишнього середовища або раціону харчування і частіше зустрічається в молодому віці. Виникнення дифузного типу раку шлунка корелює з генетичними факторами, групою крові, спадковістю.
Для опису макроскопічних параметрів пухлини дослідники застосовують різні схеми класифікації раку шлунка. Відповідно до найбільш-вдалою, на наш погляд, класифікацією, запропонованої Borrmann в 1926 р, всі пухлини шлунка можна розділити на 5 категорій:
тип I — поліповідний, або грибоподібний тип, який характеризується екзофітним зростанням в напрямку просвіту шлунка,
тип II — блюдцеобразний тип, що характеризується екзофітним зростанням з виразкою в центрі пухлини,
тип III — виразково-інфільтративний тип, характеризується виразкою инвазивно зростаючої пухлини,
тип IV — дифузно-інфільтративний тип (linitis plastica), що характеризується дифузним ураженням стінок шлунка, з мінімальною поразкою слизової оболонки і дифузнимпоразкою інших шарів стінки шлунка. Пухлина тривалий час протікає малосимптомний, що призводить до того, що абсолютна більшість пацієнтів надходить в клініку в занедбаному стані,
тип V — некласифікований рак, який характеризується поєднанням ознак інших перерахованих вище типів пухлини.
Підвищений інтерес до виявлення раннього раку при ендоскопічному дослідженні призвів до розробки класифікації, заснованої на ендоскопічної макроскопічної картині захворювання. Термін «ранній рак» застосовується щодо раку шлунка, обмеженого межами слизової і підслизової оболонок, незалежно від стану регіонарних лімфатичних вузлів. Ранній рак шлунка поділяють на три групи: тип I — протрузірующій, тип II — поверхневий, тип III — блюдцеобразний. Тип II поділяють на три підгрупи:
1) піднятий,
2) плоский,
3) приспущений.
В Японії за останні 20 років частота виявлення раннього раку шлунка збільшилася з 5 до 40%. У західних країнах ранній рак шлунка виявляється приблизно в 9% випадків.
Локалізація пухлини має свої закономірності і прогностичну значимість. Рак проксимального відділу шлунка, іноді з поширенням на нижню третину стравоходу, зустрічається приблизно в 15% випадків. Як було зазначено раніше, захворюваність на рак проксимального відділу має тенденцію до підвищення, що особливо очевидно в розвинених країнах. Рак тіла шлунка спостерігається приблизно в 30-35% випадків. Найбільш часто зустрічається рак дистального відділу шлунка — 45-50% випадків.
Для раку шлунка характерні лімфогенний, гематогенний, імплантаційний і змішаний шляхи метастазування. Поразка pei іонарних лімфатичних вузлів є прикладом лімфогенного метастазування і спостерігається у більшості пацієнтів. Частота ураження регіонарних лімфатичних вузлів залежить від глибини інвазії пухлиною стінки шлунка.
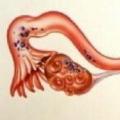
Проявом віддаленого лімфогенного метастазування є метастаз в надключичній лімфатичний вузол, розташований між ніжками лівої грудинно-ключично-соскоподібного м'яза (вузол Вирхова), і метастази в яєчники (метастази Крукенберга), які свідчить про поразку параортального лімфатичного колектора. Прикладом имплантационного поширення раку шлунка є канцероматоз очеревини, злоякісний асцит, ураження очеревини прямокишково-маточного поглиблення (метастаз Шнітцлер) і пупка (метастаз сестри Мері Джозеф).
Патогістологічна стадія пухлини залишається найбільш значущим прогностичним фактором раку шлунка. Численні клінічні випробування підтвердили визначальну роль глибини інвазії пухлиною стінки шлунка і відсутності або наявності метастатичного ураження регіонарних лімфатичних вузлів або віддалених органів в тривалості безрецидивної і загальної виживаності хворих на рак шлунка. Основною метою міжнародної класифікації є розробка методики однакового уявлення клінічних даних і можливість порівняння результатів лікування.
Патогістологічне стадирование злоякісних новоутворень шлунка проводиться за системою TNM, заснованої на трьох компонентах:
Т — поширення первинної пухлини,
N — наявність або відсутність метастазів у регіонарних лімфатичних вузлах,
М — наявність або відсутність віддалених метастазів.
у 1997 р Американський об'єднаний комітет з вивчення раку (AJCC) розробив класифікацію на підставі названих вище критеріїв:
Критерій Т (первинна пухлина):
Тх — первинна пухлина не може бути оцінена
ТО — первинна пухлина не визначається
Tis — рак in situ, внутрішньоепітеліальний рак без інвазії власної слизової оболонки (lamina propria)
TI — пухлина інфільтрує власну оболонку слизової або підслизовий шар
Т2 — пухлина інфільтрує м'язову оболонку або субсерозний шар *
ТЗ — пухлина проростає серознуоболонку шлунка, але без інвазії в сусідні органи
Т4- пухлина поширюється на сусідні структури **
Примітка.
* Пухлина може проростати м'язовий шар, залучаючи шлунково-толстокишечную і шлунково-печінкову зв'язки або великий чи малий сальник без перфорації вісцеральної очеревини, що покриває ці структури. В цьому випадку пухлина класифікується як Т2. Якщо є перфорація вісцеральної очеревини, що покриває зв'язки шлунка або сальника, то пухлина класифікується як ТЗ.
** Сусідніми структурами шлунка є селезінка, поперечна ободова кишка, діафрагма, печінка, підшлункова залоза, черевна стінка, наднирники, нирки, тонка кишка, заочеревинний простір.
внутрістеночних поширення на дванадцятипалу кишку або стравохід класифікується за найбільшою глибиною інвазії при всіх локалізаціях, включаючи шлунок.
Критерій N (стан регіонарних лімфатичних вузлів)
Регіонарними для раку шлунка є перігастральних лімфатичні вузли, розташовані вздовж малої і великої кривизни, а також уздовж лівої шлункової, загальної печінкової, гепатодуоденальной, селезінкової і чревной артерій. Регіонарними для раку кардіоезофагеального переходу є паракардіальние лімфатичні вузли, а також лімфатичні вузли вздовж лівої шлункової, чревного артерій, діафрагмальні, нижні медіастинальні і навколостравоходну лімфатичні вузли. Поразки інших внутрішньочеревних лімфатичних вузлів розцінюються як віддалені метастази.
Nx — недостатньо даних для оцінки регіонарних лімфатичних вузлів
N0 — немає ознак метастатичного ураження регіонарних лімфатичних вузлів
N1 — є метастази в 1-6 регіонарних лімфатичних вузлах
N2 — є метастази в 7 15 регіонарних лімфатичних вузлах
N3 — є метастази в більш ніж 15 регіонарних лімфатичних вузлах
Критерій М (віддалені метастази)
МХ — недостатньо даних для визначення віддалених метастазів
МО — немає ознак віддалених метастазів
М1 — євіддалені метастази
Вод її досконалою з точки зору інтеграції морфологічних досліджень, які виконуються на всіх етапах лікування хворого і визначають стадію захворювання, є класифікація, запропонована Японською асоціацією з вивчення раку шлунка (JCGC) в 1998 р Стадіювання не змінюється після першого визначення і ділиться на наступні типи:
1) клінічне — с,
2) хірургічне — s,
3) морфологічний — р,
4) остаточне — f.
Крім характеристики первинної пухлини в залежності від глибини інвазії (критерій Т), рак шлунка описується і в залежності від локалізації. Шлунок ділиться на три частини: верхню (U), середню (М) і нижню (L) третини шлунка. Якщо пухлина залучає більше 1/3 шлунка, то спочатку вказується третину, в якій розташована основна маса пухлини. Відповідно до поперечним перерізом шлунка, пухлина шлунка може розташовуватися на передній (ant) або задньої (post) стінці, малої (less) або великий (gre) кривизні.
За класифікацією, запропонованої JCGC, градація регіонарних лімфатичних вузлів будується в залежності від локалізації патологічного вогнища. Така система угруповання лімфатичних вузлів заснована на дослідженнях з вивчення шляхів лімфовідтоку при раку шлунка різної локалізації, а також на даних виживати — ги в залежності від ураження кожної групи лімфатичних вузлів. Відповідно до класифікації JCGC, метастатична поразка лімфатичних вузлів проходить в три етапи. На першому етапі уражаються перігастральних лімфатичні вузли, розташовані в зв'язках шлунка. До них відносяться:
1) праві паракардіальние лімфатичні вузли,
2) ліві паракардіальние лімфатичні вузли,
3) лімфатичні вузли малої кривизни шлунка,
4) лімфатичні вузли великої кривизни шлунка,
5) супрапілоріческіе лімфатичні вузли,
6) субпілоріческіе лімфатичні вузли.
До лімфатичних вузлів другого етапу метастазування відносяться лімфатичні вузли, розташовані по ходу чревного стовбура і його гілок, загальної печінкової, лівої шлункової, селезінкової артерій, а також в воротах селезінки. До груп другого етапу відносяться:
1) лімфатичні вузли по ходу лівої шлункової артерії,
2) лімфатичні вузли по ходу загальної печінкової артерії,
3) лімфатичні вузли навколо чревного стовбура,
4) лімфатичні вузли у воротах селезінки,
5) лімфатичні вузли вздовж селезінкової артерії,
6) лімфатичні вузли печінково-дванадцятипалої зв'язки.
Різні групи лімфатичних вузлів, навіть групи, що відносяться до першого етапу лімфогенного метастазування, можуть розглядатися як наступний етап метастазування або як прояв віддаленого метастазування в залежності від локалізації пухлини в шлунку. Так, метастатична поразка лівих паракардіальние лімфатичних вузлів (група №2) при раку нижньої третини шлунка розцінюється як віддалений метастаз.
Клініка раку шлунка
Ранній рак шлунка може проявлятися симптомами диспепсії різного ступеня вираженості. При раку з інвазією тільки слизової оболонки скарги на диспепсичні розлади пред'являють більш 50% хворих, тому при наявності диспепсії і віці старше 40 років рекомендовано проведення ендоскопічного дослідження. При наявності диспластичних змін слизової оболонки шлунка необхідно регулярне виконання ендоскопічного дослідження. Тривалість наявності симптомів до виконання хірургічного втручання при ранньому раку шлунка коливається від 3 до 72 міс. При ранньому раку шлунка фізикальні ознаки захворювання відсутні, хоча у частини хворих (близько 10%) при пальпації визначається незначна хворобливість у верхніх відділах черевної порожнини.
На ранніх етапах розвитку раку шлунка перебіг захворювання може бути безсимптомним. При появі неспецифічних скарг пацієнти частіше відносять їх до проявів функціональних розладів верхніх відділів шлунково-кишкового тракту і тривалий час не звертаються за медичною допомогою. Однак при ретельному зборі анамнезу навіть на ранніх етапах розвитку хвороби можна виявити скарги, характерні для раку шлунка. Так, відчуття «розпирання живота» або незначний біль в кінці прийому їжі можуть свідчити про рак антрального відділу шлунка. Симптоми раку можуть нагадувати такі при виразковій хворобі шлунка, особливо при локалізації пухлини по малій кривизні. Пухлина кардіального відділу шлунку у 60% пацієнтів може проявитися дисфагией, що свідчить про обструкцію більше 80% просвіту абдомінального відділу стравоходу або кардії. При цій локалізації раку шлунка виникає необхідність диференціювання з ахалазії або раком стравоходу. Патогномонічні симптоми раку шлунка виникають при великих розмірах первинної пухлини, що призводить до обструкції просвіту шлунка, при порушеннях функціонального характеру, які є наслідком залучення в пухлинний процес великої частини стінки шлунка, при виникненні кровотеч. Більше 70% пацієнтів відзначають появу скарг за більш ніж 6 міс. до звернення до лікаря. Найбільш характерними скаргами є відчуття тяжкості і біль в епігастрії, що посилюються після їжі, зниження маси тіла, нудота, блювота недавно з'їденої їжею, гематомезіс, мелена, анорексія, швидке насичення при їжі, здуття живота. Больовий синдром при раку шлунка може симулювати з тенокардію або доброякісну патологію шлунка, слабшаючи після прийому їжі.
Приблизно у 10% пацієнтів при первинному зверненні визначаються пальповані лімфатичні вузли на шиї, асцит, жовтяниця, пальпується утворення в черевній порожнині. Однак наявність пальпируемой пухлини в черевній порожнині не завжди свідчить про нерезектабельних раку шлунка. Метастаз сестри Мері Джозеф у вигляді пальпируемого вузла в області пупка — досить часте прояв запущеного раку шлунка, є несприятливим фактором прогнозу. При появі цього симптому медіана виживаності становить не більше 3,5 міс. Рідше спостерігається поверхневий тромбофлебіт нижніх кінцівок (симптом Труссо).
Клінічна картина раку шлунка визначається локалізацією пухлинного процесу в шлунку.
Рак проксимального відділу шлунка може проявлятися дисфагією, яка призводить до білкового голодування, гіповолемії. Надалі приєднуються загальна симптоматика у вигляді слабкості, швидкої стомлюваності, схуднення, запаморочення та ін. Дисфагия часто супроводжується рясним слинотечею. Рак фундального відділу шлунка до появи клінічної симптоматики може досягати значних розмірів, поява больового синдрому свідчить про поширення пухлини на сусідні структури.
Рак середньої третини шлунка довгий час не проявляється клінічно. Хворі частіше скаржаться загального характеру. При виразці пухлини може спостерігатися субфебрильна температура, а при пухлинах малоїкривизни одним з перших клінічних ознак захворювання служить шлункову кровотечу. Поява або посилення больового синдрому при раку, що локалізуються в середній третині шлунка, може свідчити про поширення пухлини на підшлункову залозу.
Рак нижньої третини шлунка на ранніх етапах розвитку може проявлятися диспепсією, неприємним запахом з рота. У міру зростання пухлини і стенозирования просвіту вихідного відділу шлунка приєднуються спочатку відрижка повітрям, потім блювота з'їденої напередодні їжею. У зв'язку з порушенням пасажу їжі по шлунково-кишковому тракту поступово наростає симптоматика загального характеру.
Діагностика раку шлунка
Лабораторні дослідження
Не існує специфічних для раннього раку шлунка лабораторних тестів. Однак лабораторні дані можуть зазнавати зміни при розповсюдженому раку шлунка. Найбільш частою знахідкою є залізодефіцитна мікроцітарная гіпохромна анемія. Навіть при ранньому раку у 20% хворих відзначається зниження рівня гемоглобіну. Кількість тромбоцитів і показники згортання крові залишаються в межах норми, за винятком випадків масивної кровотечі, дисемінованоговнутрішньосудинного згортання, метастатичного ураження печінки, легенів, підшлункової залози, селезінки і кісткового мозку.
Серед біохімічних показників можна відзначити незначне підвищення рівня активності лактатдегідрогенази і лужної фосфотаза і зниження рівня альбуміну, деяких фракцій білків, заліза і феритину в сироватці крові.
Проба на приховану кров в калі може бути негативною приблизно у половини хворих з поширеним раком шлунка. Разом з тим, позитивна бензідіновая проба може бути характерна для пацієнтів з патологією в будь-якому відділі шлунково-кишкового тракту: пептичні виразки, ерозії, гінгівіт, рефлюкс-езофагіт, геморагічний гастрит, гемобілія, коліт, поліпи товстої кишки, колоректальний рак, гемороїдальні вузли. Аналіз калу на приховану кров може давати хибнопозитивний результат, особливо якщо хворий напередодні вживав в їжу біфштекси з кров'ю, ріпу, брокколі і редис. У людей старше 40 років позитивний результат служить показанням для дослідження товстої кишки (колоноскопія або ректороманоскопія + ирригоскопия з подвійним контрастуванням).
Рівень пухлинних маркерів не підвищується при ранньому раку шлунка. Найбільш характерними для поширеного раку шлунка є СА19-9, СА50, СА72-4, СА546 і РЕА. Високо- і помірно диференційовані пухлини характеризуються підвищенням рівня як мінімум 2-3 маркерів, в той час як у пацієнтів з низько- і недиференційованими пухлинами шлунка рівень маркерів не підвищується. Багатофакторний аналіз свідчить про те, що пухлинні маркери є незалежними факторами прогнозу і за своєю значимістю поступаються лише критеріям Т, N і М.
Ендоскопічне дослідження
спрямоване на вирішення таких двох завдань: скринінг для виявлення хворих з непухлинна патологічними змінами слизової оболонки і формування груп ризику, виявлення раку шлунка. Під час ендоскопічного дослідження фіксуються кордону, характер росту, форма пухлини, відсутність або наявність поширення на стравохід. У рішенні другої задачі велике значення має виявлення раннього раку. У деяких випадках виникає необхідність хромоендоскопіческого дослідження. Для цього слизову оболонку шлунка фарбують 0,1% розчином индигокармина, що дає можливість візуалізувати кордону інфільтрації навіть при ендофітний зростанні раку і синхронних пухлинах або метастазах по слизовій оболонці шлунка. Для морфологічної діагностики проводиться біопсія пухлини з метою отримання матеріалу для гістологічного і цитологічного дослідження.
Ендоскопічне ультразвукове дослідження
Ендоскопічне ультразвукове дослідження шлунка в багатьох спеціалізованих медичних центрах світу входить в реєстр стандартних методів обстеження. Прямий контакт ультразвукового датчика зі стінкою шлунка дозволяє отримати високу ступінь дозволу при візуалізації шарів стінки органу. Це робить ендосонографія ідеальним методом для оцінки глибини інвазії відповідно до класифікації по TNM. Критеріями метастатичного ураження лімфатичних вузлів є розміри вузла більше 5 мм в діаметрі, округла форма (для запальних вузлів більш характерна сферична форма) і чітко окреслені контури. Таким чином, ендосонографія є ефективний і загальноприйнятий метод стадирования раку шлунка. При оцінці глибини інвазії (Т) і стану регіонарнихлімфатичних вузлів (N) точність, чутливість та специфічність методу, за даними різних авторів, становить від 80 до 95%.
Ендосонографія
Однією з пріоритетних завдань ендосонографії останнім часом стає оцінка ефекту проведеної неоад'ювантної терапії, так як в лікуванні раку шлунка все більшу роль відіграє комбіноване лікування. Дослідження, виконане до початку лікування, не володіє прогностичної значимості щодо можливого ефекту хіміо- або химиолучевого лікування. Відновлення структурності стінки шлунка, встановлене на підставі ендоскопічного УЗД, очевидно, є ознакою повного ефекту у хворого після проведення неоад'ювантного лікування, проте в деяких випадках дані ендосонографії досить важко інтерпретувати внаслідок розвитку в первинної пухлини або на її місці запальних і фибротических змін.
Рентгенологічне дослідження
Рентгенологічне дослідження з використанням в якості контрасту суспензії сульфату барію переслідує дві головні завдання: скринінг раку шлунка і визначення поширеності (глибини інвазії і протяжності) злоякісного процесу. Найуспішніше перша задача була вирішена в Японії. При цьому першочерговим є не виявлення раку шлунка, а формування груп ризику для подальшого спостереження. Вирішення другого завдання особливо актуальне перед проведенням хірургічного втручання.
Основними методами контрастного рентгенологічного дослідження є туге заповнення і подвійне контрастування.
При ранньому раку шлунка з екзофітним характером росту під час рентгенологічного дослідження виявляється дефект наповнення. Розмір дефектів наповнення коливається від 1 до 4 см в діаметрі. Однак найбільше значення при інтерпретації даних контрастного дослідження має характер поверхні поліповидного освіти. Контури доброякісного гіперпластичного поліпа чіткі, рівні, в той час як для злоякісної пухлини більш характерні нерівні, зазубрені контури пухлини. Однак, незважаючи на нерівність контурів раннього раку, рельєф поверхні поліповидного раннього раку має схожість з рельєфом навколишньої слизової оболонки шлунка. Таким чином, при раку шлунка з інвазією стінки шлунка не глибше підслизового шару поверхню пухлини має такі ж контури, як і навколишня слизова оболонка. Ця ознака має найбільше значення в диференціюванні раннього і поширеного раку шлунка. У міру зростання пухлини і залучення в пухлинний процес більш глибоких шарів стінки шлунка схожість між рельєфом слизової оболонки і поверхні пухлини втрачається, з'являються ерозії, виразки (тип II по Боррманну), що спостерігається приблизно в 26-27% випадків раку шлунка. Іноді, незважаючи на збільшення розмірів пухлини, не відбувається її виразки, цей тип пухлини спостерігається в 2-3% випадків (тип I по Боррманну). Перистальтика на рівні поразки не простежується, складки слизової оболонки обриваються у краю дефекту наповнення.
При ранньому ендофітний раку шлунка рентгенологічна картина визначається двома вимірами, при розповсюдженому раку — трьома. Іншими словами, при ранньому раку глибина інвазії може бути опущена, в той час як цей параметр носить визначальне значення в найбільш поширених стадіях захворювання. Контури раннього раку з інфільтративним характером росту чітко простежуються, однак в деяких випадках, коли межа між нормальною слизовою оболонкою шлунка і раннім раком розмита, виявлення раннього раку представляє значні труднощі.
Поширений рак шлунка з інфільтративним характером росту найбільш часто рентгенологічно представлений дефектом наповнення або депо барію, піднятими краями пухлини і відсутністю перистальтики в ураженої частини шлунка. У випадках незначного залучення власної м'язової оболонки поширений рак шлунка рентгенологічно нагадує ранній рак. Така форма поширеного раку відноситься до типу V по Боррманну.
Тип III по Боррманну зустрічається в 40-45% випадків і характеризується наявністю дефекту наповнення, кратера з нерівними контурами в центрі пухлини і відсутністю перистальтики навколо патологічного вогнища, що обумовлено інфільтративним ростом раку. (Кладки слизової оболонки обриваються у краю пухлини.
Тип IV по Боррманну зустрічається в 21% випадків поширення раку шлунка. У західній літературі цей тип отримав назву дифузійної инфильтративной карциноми. Рентгенологічна картина потовщення стінки шлунка на значній ділянці обумовлена інфільтрацією пухлинної тканиною і розвитком фибротических змін. Рентгенологічно шлунок деформований , погано розтягується, найбільш часто спочатку уражається антральний відділ. Іпоследствіі ерозії і виразки займають значну поверхню пухлинного ураження.
Linitis plastica є різновидом IV типу поширеного раку по Боррманну, спостерігається найчастіше у віці до 40 років. Рентгенологічно характеризується деформацією і зменшенням розмірів шлунка, потовщенням складок. Виявлення linitis plasllea на ранніх етапах розвитку пухлини представляє значні фудності і є єдиною невирішеною проблемою в діагностиці раннього раку шлунка.
Комп'ютерна томографія
Комп'ютерна томографія грудної клітини та черевної порожнини гакже входить до переліку досліджень, необхідних для оцінки місцево-поширеного пухлинного процесу. КТ дозволяє встановити розміри первинної пухлини, збільшені лімфатичні вузли заочеревинного простору, метастази в легеневої тканини і печінки, наявність уражених метастазами лімфатичних вузлів по ходу чревного стовбура і його гілок. Важливою умовою правильного планування лікування є точна оцінка поширеності Процесу. Незважаючи на те що КТ входить в алгоритм обстеження хворого на рак стравоходу, метод малоефективний у визначенні глибини інвазії стінки шлунка пухлиною.
Ультразвукова комп'ютерна томографія
Ультразвукова комп'ютерна томографія органів черевної порожнини, заочеревинного простору і шийно-надключичних зон дозволяє виявити метастатичне ураження лімфатичних вузлів у відповідних анатомічних областях, а також віддалені метастази в печінці і нирках.
П
озітронно-емісійна томографія (ПЕТ)
Злоякісні пухлини характеризуються підвищеним метаболізмом глюкози. ПЕТ з використанням міченої радіоактивним ізотопом фгор-18-дезоксиглюкозу (ФДГ) дозволяє візуалізувати і кількісно оцінювати метаболізм глюкози в пухлинної тканини. ФДГ фосфорилируется за участю ферменту гексокінази, перетворюється в ФДГ-6-фосфат і накопичується в тканинах. До моменту виконання I Г) Т (через 60 хв після ін'єкції) активність метаболізму глюкози в тканинах представлена концентрацією ФДГ-6-фосфату в пухлини. Застосування ПЕТ ефективно для виявлення первинного вогнища, уражених лімфатичних вузлів і віддалених метастазів при раку легені, молочної залози, лімфоми, плоскоклітинному раку голови і шиї, злоякісних пухлинах опорно-рухового апарату і колоректальний рак. І тільки останнім часом з'явилися дані про ефективність методу в діагностиці раку шлунка.
Лікування раку шлунка
При адекватному лікуванні раннього раку шлунка виживання може перевищувати 90%. Частота ураження регіонарних лімфатичних вузлів при TI з інвазією в межах слизової оболонки становить близько 4%, з інвазією підслизового шару — 23% і корелює з такими факторами, як форма росту, наявність виразки, розмір, ступінь диференціювання пухлини. Тому при високодиференційований пухлини розмірами менше 3 см в найбільшому вимірі і без ознак виразки можлива її ендоскопічна резекція.
Хірургічне лікування
Хірургічний метод залишається основним в лікуванні раку шлунка. Згідно з рекомендаціями ESMO (2005 р), Хірургічне лікування рекомендовано при наступній поширеності пухлинного процесу по системі TNM: Tis-T3N0-N2M0 і T4N0M0. При раку шлунка виконуються гастректомія або резекції шлунка різного об'єму з видаленням зв'язкового апарату і регіонарних лімфатичних вузлів. Субтотальна проксимальна резекція шлунка проводиться при екзофітної раку проксимального відділу шлунка, що не поширюється за межі кардії. Показанням до субтотальної дистальної резекції шлунка є екзофітна пухлина дистального відділу шлунка, що не поширюється проксимальніше кута шлунка. При інфільтративних пухлинах різної локалізації, тотальну поразку, екзофітної пухлини тіла шлунка показана гастректомія. З метою досягнення радикальності хірургічного втручання при типі I і II по Боррманну необхідно відступати більш ніж на 3 см від проксимального краю пухлини, при типі III і IV — на 6 см. Опубліковані дані не дозволяють стверджувати перевага одного обсягу хірургічного втручання над іншим. Обсяг лімфодіссекціі є предметом спору до сьогоднішнього дня. Лімфодіссекція D2 є стандартним обсягом при виконанні хірургічного втручання з приводу раку шлунка відповідно до рекомендацій JCGC. У проведених в Японії клінічних дослідженнях виявлено поліпшення виживаності при відсутності збільшення частоти ускладнень і смертності пацієнтів, які зазнали резекції шлунка з лімфодіссекціей D2. Однак дослідження MRC і голландської групи з вивчення раку шлунка, в яких брало участь 400 і 711 пацієнтів відповідно, не виявили збільшення виживаності після лімфодіссекціі D2. В обох дослідженнях в групі пацієнтів з розширеною лімфодіссекціей відзначено збільшення частоти післяопераційних ускладнень і смертності, що, найімовірніше, було пов'язано з виконанням цим пацієнтам дистальної резекції підшлункової залози і спленектомії, процедур, в яких немає необхідності для видалення лімфатичних вузлів. Крім того, обсяг лімфодіссекціі не завжди відповідав обсягу L) l або D2, що додатково ускладнило інтерпретацію результатів і порівняння груп.
Хіміотерапія
Хіміотерапія в самостійному варіанті лікування застосовується у хворих на дисемінований рак шлунка. Основними хіміопрепаратами при цьому захворюванні є фторурацил, цісплагін, мітоміцін і таксани. За даними літератури, частота об'єктивних ефектів при проведенні хіміотерапії названими препаратами коливається від 17 до 30%. Застосування хіміотерапії, за даними рандомізованих досліджень, дозволяє продовжити життя хворим з віддаленими метастазами до 12 міс.
При використанні комбінованої хіміотерапії ефективність лікування вище. Найбільш часто вживаними схемами є PF (цисплатин і фторурацил), ELF (фторурацил, кальцію фолінат і лейковорін), FAMTX (фторурацил, доксорубіцин, кальції фолінат і метотрексат), PEF (цисплатин, етопозид і фторурацил).
В останнім часом набуло визнання застосування таксанов, іринотекану, капецитабіну. Застосування доцетакселу і цисплатину виявилося ефективним у 37% хворих на рак шлунка.
неоад'ювантна хіміотерапія
Необхідність хіміотерапії на першому етапі комбінованого лікування раку шлунка підтверджена дослідженнями на аутопсійному матеріалі, в яких показано, що вже на ранніх етапах рак цієї локалізації часто набуде системного характеру. Сучасні дослідження з вивчення Ефективності лапароскопії та ПЕТ в оцінці поширеності пухлини підтверджують цю тезу. Неоад'ювантна лікування призводить до зменшення основної маси пухлини у більшості хворих, підвищенню резектабельності, зменшує ризик інтраопераційного обсіменіння рани пухлинними клітинами. Крім того, гістологічне дослідження видаленого препарату дає можливість об'єктивно оцінити ефект проведеного до операції лікування. Існують кілька теоретичних і експериментальних обгрунтувань застосування хіміотерапії саме на передопераційному етапі лікування хворих на рак шлунка. Експериментальні дослідження показують, що оперативне втручання стимулює ріст клітин пухлини, які залишаються в організмі пацієнта після операції. Про це свідчать підвищення індексу проліферації, значне зменшення часу реплікації клітин і швидке збільшення кількості і розмірів віддалених метастатичних вогнищ після оперативного втручання. Підвищення індексу проліферації може супроводжуватися мутаціями, що приводять до формування клонів клітин, резистентних до хіміотерапії. Додатковим аргументом на користь застосування неоад'ювантного лікування (хіміотерапії) на передопераційному етапі є найкраща доставка хіміотерапевтичних агентів в пухлинну тканину в умовах нескомпрометованих хірургічним втручанням кровотоку в ложі пухлини.
До теперішнього часу в літературі опубліковані результати трьох клінічних досліджень, присвячених вивченню впливу неоад'ювантної хіміотерапії на ефективність лікування. В результаті хіміотерапії до оперативного втручання вдалося домогтися зменшення поширеності пухлинного процесу, проте нив жодному з них не вдалося поліпшити виживання хворих в групі з передопераційної хіміотерапією.
Ад'ювантна хіміотерапія
Метастатичне ураження лімфатичних вузлів є прогностично несприятливим фактором у пацієнтів, які отримали радикальне хірургічне лікування, що дає підставу для спроб поліпшення виживаності у пацієнтів високого ризику шляхом використання ад'ювантної хіміотерапії. В літературі опубліковано велику кількість клінічних випробувань щодо застосування хіміотерапії в післяопераційному періоді. Завершення на сьогоднішній день дослідження, присвячені вивченню ролі ад'ювантної хіміотерапії після оперативного лікування, не дозволяють зробити остаточних висновків про її ефективності. Лише в декількох з них вдалося домогтися поліпшення результатів лікування в групі з комбінованим лікуванням в порівнянні з хворими, яким було проведено тільки хірургічне лікування. Разом з тим, мета-аналіз всіх клінічних досліджень показує незначне, але явне поліпшення виживаності в основній групі хворих. Для підтвердження цих даних необхідно проведення ретельно спланованих клінічних досліджень з використанням нових ефективних препаратів. Найбільш часто вживаними препаратами є мітоміцін, фторурацил, антрацикліни. Найчастіше використовується поєднання двох і більше препаратів.
Ад'ювантна інтраперитонеального хіміотерапія
Застосування цього режиму ад'ювантного лікування обумовлено досить високою частотою розвитку рецидивів в черевній порожнині. Були проведені клінічні дослідження щодо застосування цисплатину, митомицина і фторурацилу для інтраперитонеальної ад'ювантної хіміотерапії. Однак значного поліпшення віддалених результатів не було.
Променева терапія
Як самостійний метод променева терапія проводиться в разі локорегіонарного рецидиву раку шлунка після хірургічного лікування або як додаткове лікування при наявності пухлинних клітин по лінії резекції хірургічного препарату. Застосування променевої терапії в ад'ювантному режимі до теперішнього часу залишається експериментальним напрямком в лікуванні раку шлунка. Більш широке поширення набуло застосування променевої терапії в поєднанні з хіміотерапією в ад'ювантном і неоад'ювантному режимах. Незважаючи на попередні сприятливі результати, воно не може бути рекомендований до широкого застосування в передопераційному або післяопераційному лікуванні.
Прогноз раку шлунка
За статистичними даними, найбільш сприятливий прогноз характерний для раку антрального відділу і пілоричного каналу шлунка — 5-річна виживаність перевищує 35%. Найменш сприятливо протікає рак проксимального відділу шлунка — виживаність менше 20%. Проміжне становище займає рак тіла шлунка, 5-річна виживаність при цій локалізації коливається від 25 до 35%.