Архив рубрики: Неврологія
Синдром вегетосудинної дистонії
Клінічне вчення про патології вегетативної нервової системи пов'язано з іменами Еппінгер і Гесса (1910), створили уявлення про синдром ваготонии. З урахуванням поділу вегетативної нервової системи на симпатичний і парасимпатичний відділи незабаром з'явився опис і другого узагальненого вегетативного синдрому — симпатикотонии. У класичному викладі вони виглядали наступним чином. У людини з сімпатікотоніческой напруженістю виявляються блідість і сухість шкіри, холодні кінцівки, блиск очей і легкий екзофтальм, нестійка температура, схильність до тахікардії, тахіпное, тенденція до підвищення артеріального тиску, запори. Характерні велика працездатність, особливо під вечір, при знижених здібностях до до запам'ятовування і зосередження, і ініціативність, тривожність, фізична витривалість. Ці особи погано переносять сонце, тепло, шум, яскраве світло, кава, сон у них неспокійний. Мають місце тремтіння кінцівок, м'язове тремтіння, парестезії, мерзлякуватість, неприємні відчуття в області серця.
Для ваготонии характерні холодна, волога, бліда шкіра, гіпергідроз і гіперсалівація, яскравий червоний дермографізм, брадикардія , тенденція до артеріальної гіпотонії, дихальна аритмія, схильність до непритомності і набирання масі. Відзначаються апатичність, астенія, мала витривалість, низька ініціатива, нерішучість, боязкість, чутливість, схильність до депресії. Ці особи більш працездатні в ранкові години.
Слід зазначити кілька обставин. По-перше, викладені патерни ще не є оформленими патологічними синдромами і швидше відображають наявність певних (часто конституційних) особливостей організації та реагування вегетативної нервової системи, по-друге, в них досить повно знайшли відображення прояви, які і складають при їх більшої виразності узагальнений синдром вегетосудинної дистонії. По-третє, вкрай істотно, що вже в цих описах вегетативні симптоми дані в поєднанні з особливостями особистості та емоційного реагування.
Вчення про симпатикотонии і ваготонии піддавалося частою критиці, основу який складали уявлення про відсутність в реальній практиці таких чистих синдромів. Виходячи з цього, Гійом виділяє проміжний симптомокомплекс — невротонію, а Даніелопуполо позначає його як гіпер- або гіпоамфотонію. Дійсно, частіше доводиться мати справу зі змішаними симпатичними або парасимпатическими проявами, однак нерідко вдається виділити переважну спрямованість в окремих функціональних системах (наприклад, симпатичну активацію в кардіоваскулярної і парасимпатичну в гастроинтестинальной системах).
При всіх застереженнях і поповнення слід визнати , що принцип поділу вегетативних порушень по сімпатікотоніческім і ваготоніческім проявам залишився актуальним і сьогодні. Другий принцип поділу пов'язаний з перманентністю і пароксизмальних вегетативних порушень. Якщо останні є окреслені в часі інтенсивні вегетативні бурі, то позначення інших порушень як перманентних певною мірою умовно. Всі вегетативні симптоми лабільні, рухливі. Це відноситься і до гіпергідрозу, і частотою серцевих скорочень, і рівнем артеріального тиску. Таким чином, перманентні порушення — це не абсолютно стабільні вегетативні показники, але вони коливаються в межах, що не досягають рівня вегетативних кризів. Останні описані клінічно досить давно і мають в спеціальній літературі позначення вазо-вагальних кризів Говерса, симпатичних кризів Барре і змішаних сімпатіковагальних нападів Польцер.
Симпатико-адреналової кризи характеризуються неприємними відчуттями в області грудної клітини та голови, тахікардією, підйомом артеріального тиску , мідріазом, ознобоподобное гіперкінезом, вираженими відчуттями страху, тривоги. Завершується напад полиурией світлою сечею.
вагоінсулярние (парасимпатичні) кризи виявляються запамороченням, нудотою, зниженням артеріального тиску, іноді брадикардія, екстрасистолією, утрудненням дихання, шлунково-кишковими дискінезіями.
Нерідко кризи носять змішаний характер, коли ознаки симпатичної і парасимпатичної активації виникають одночасно або послідовно слідують один за іншим.
Вегетативні порушення можуть бути генералізованими, системними або локальними. Перші проявляються одночасно в усіх вісцеральних системах, включають в себе і шкірні вегетативні розлади і порушення терморегуляції. Нерідко вегетативні прояви переважно захоплюють яку-небудь одну систему, найчастіше кардіовас-кулярную, найбільш динамічну і психологічно значущу для хворого. В англо-саксонської літератури цей синдром позначають як «нейроциркуляторну астенію», у вітчизняній — як «нейроциркуляторну дистонію».
Є і інші синоніми цього синдрому: солдатське або дратівливе серце, синдром Де Коста, синдром зусиль, нестійкість серця, тахікардіческій невроз, вазорегуляторная астенія. Клінічно спостерігаються серцебиття, болі в лівій половині грудної клітини, астенія, дратівливість, порушення сну, головний біль, запаморочення, парестезії, открижка.
Виразних соматичних порушень виявити при цьому не вдається.
Описана і нейропіщеварітельная астенія, або нейрогастральная дистонія, де на перший план виступають суб'єктивні скарги з боку травного тракту, а об'єктивно є діскінетіческій синдром.
Вегетативні розлади можуть переважно виявлятися в терморегуляторного середовищі: тривалі неінфекційні субфебрилітет, фебрильні кризи. Локальні вегетативні порушення можуть виникнути в одній половині голови, дистальних відділах кінцівок, переважно у вигляді латералізованние проявів на тулубі та кінцівках. Симпатичні, парасимпатичні і змішані симптомокомплекси (перманентні і пароксизмальні), що носять генералізований, переважно системний або локальний характер, об'єднуються в синдром вегетосудинної дистонії. Іншими, менш вдалими, але існуючими в літературі термінами, є: «дізвегетоз», «амфодістонія» ,. «Вегетативна лабільність», «вегетативна атаксія», «невровегетатівная дистонія», «сімпатози», «вегетативно-судинна дисфункція», «вегетоневрози», «діенцефалози» і т. Д.
Синдром вегетосудинної дистонії не є нозологічною формою і лише синдромальну відображає наявність конституціональної або придбаної вегетативної дисфункції.
Діагностика його складається з двох етапів:
1) при наявності характерних скарг і певних об'єктивних симптомів порушення функції різних систем організму необхідно виключення органічної патології певних вісцеральних систем. Таким чином, діагноз базується на позитивному аналізі наявних проявів хвороби і виключення соматичного органічного захворювання. Як правило, цей етап діагностики утруднень не викликає,
2) складнішим є нозологічний і топографічний (визначення рівня ураження) аналіз синдрому вегетосудинної дистонії. Однак він необхідний як з теоретичних, так і практичних позицій. Добре відома достатня стійкість вегетативних порушень, їх слабка курабельность. Все це часто є наслідком спроб лікування безпосередньо вегетативних розладів без урахування їх природи.
З певною часткою схематичності можна виділити 8 факторів, що викликають вегетативні порушення.
1. Синдром вегетосудинної дистонії конституціональної природи
Синдром вегетосудинної дистонії конституціональної природи зазвичай проявляється з раннього дитячого віку і характеризується нестійкістю, лабільністю вегетативних параметрів. Швидка зміна забарвлення шкіри, пітливість, коливання частоти серцевих скорочень і артеріального тиску, біль і дискінезії в шлунково-кишковому тракті, схильність до субфебрилитету, нудота, погана переносимість фізичного та розумового напруження, метеотропность. Еппінгер, а потім Гійом визначали їх образно як «інвалідів вегетативної системи», ще не хворих, але схильних до посилення всіх зазначених проявів при несприятливому впливі зовнішнього середовища. Нерідко ці розлади носять сімейно-спадковий характер. З віком вказані хворі при правильно загартовувати вихованні досягають відомої компенсації, хоча все життя залишаються вегетативно стигматизованих. Однак рідко є і дуже важкі вегетативні порушення. Йдеться про сімейне дизавтономія, синдромі Рилєєв — Дея, при якому виникають грубі порушення у внутрішньому середовищі організму, несумісні з життям.
2. Синдром вегетосудинної дистонії, що виникає на тлі ендокринних перебудов організму
Він з'являється в періоди пубертату і клімаксу. В пубертатному віці, є дві причини до появи вегетативних синдромів: виникнення нових ендокринно-вегетативних взаємовідносин, які потребують формування інших інтеграційних патернів, і швидка, часто акселірірованная прибавка зростання, при цьому створюється розрив між новими фізичними параметрами і можливостями судинного забезпечення. Типовими проявами є вегетативні порушення на тлі м'яких або виражених ендокринних розладів, коливання артеріального тиску, ортостатичні синдроми з предобморочному і непритомний стан, емоційна нестійкість, порушення терморегуляції.
Вегетативні процеси загострені і в період клімаксу, що пов'язано з фізіологічним ендокринних і емоційним супроводом цього стану. Вегетативні розлади носять як перманентний, так і пароксизмальної характер, а серед останніх, крім характерних припливів, почуття жару і рясної пітливості, можуть виникати вегетативно-судинні кризи.
3. Синдром вегетативної дистонії при первинному ураженні вісцеральних органів
Йдеться про захворювання, які не мають в своєму патогенезі в якості ведучого нейрогенного фактора. До їх числа відносяться жовчнокам'яна хвороба, хронічний панкреатит, діафрагмальна грижа, хронічний апендицит, нирковокам'яна хвороба.
Механізми, що викликають вегетативні порушення, зводяться до подразнення вегетативних рецепторів, наявних в зазначених органах, залученню до процес найближчих вегетативних утворень, хронічно існуючому алгіческім синдрому. При хронічному перебігу захворювання виникають спочатку рефлекторні локальні, а потім і генералізовані вегетативні порушення.
Лікування основного захворювання часто супроводжується і поліпшенням або зникненням вегетативної дисфункції.
4. Синдром вегетосудинної дистонії при первинних захворюваннях периферичних ендокринних залоз (щитовидної, наднирників, яєчників)
Зниження або посилення секреції зазначених залоз тягне за собою порушення ендокринно-вегетативного рівноваги. Викид в кров активних біологічних речовин (тироксину, катехоламінів, стероїдів, інсуліну), тісно взаємодіючих з вегетативними системами, зниження їх секреції є факторами, які сприяють виникненню вегетативних порушень генералізованого характеру.
5. Алергія
Алергія — ще одна причина виникнення вегетативних порушень. Вона є результатом багатьох чинників: масові вакцинації, зміна навколишнього середовища, застосування препаратів, які є продуктами органічної хімії, зіткнення в побуті з продуктами хімічної промисловості. Вегетативна нервова система, з одного боку, бере участь в патогенезі формування вегетативних порушень. Відома роль в цьому відношенні недостатності симпатико-адреналових впливів. З іншого боку, сформувалася алергію супроводжують виразні вегетативні розлади, часто носять характер розгорнутих симпатико-адреналових кризів.
6. Синдром вегетосудинної дистонії при патології сегментарної вегетативної нервової системи
Остання складається з вегетативних центрів, розташованих в центральній нервовій системі (вегетативні ядра III, IX і X черепних нервів, бічні роги спинного мозку), прегангліонарних і постгангліонарних волокон, симпатичної ланцюжка і вегетативних сплетінь. Важкі, часто вітальні, порушення з боку дихальної та кардіоваскулярної системи виявляються при патології бульбарних відділів стовбура мозку. Клінічне значення вегетативних розладів при ураженні спинного мозку (пухлинний процес, сирингомієлія) відносно невелика і вони перекриваються масивними руховими і чутливими розладами.
Частіше за інших має місце залучення до процесу прегангліонарних волокон на рівні передніх корінців спинного мозку. Як правило, причиною вегетативних розладів при цьому є остеохондроз хребта. Виникаючі корінцеві порушення включають в себе і симпаталгические прояви, і вегетативно-судинні симптоми, які можуть бути як локальними, переважно в зоні ураження корінців, так і генералізованими. Особливо це відноситься до ускладнень шийного остеохондрозу, при якому нерідко виникають загальні вегетативно-судинні кризи, пов'язані із залученням до процесу вегетативних сплетінь хребетної артерії (задній шийний симпатичний синдром, шийна мігрень, синдром Барре).
Патологія передніх корінців і проходять з ними вегетативних волокон може проявитися і поруч псевдовісцеральних синдромів, при яких виникають больові відчуття певної локалізації. Найбільш вивчений синдром «шийної стенокардії», що виявляється болями в лівій половині грудної клітини з іррідаціей в ліву руку, лопатку, іноді ліву половину голови.
Клінічно цей синдром відрізнити від справжньої стенокардії можна за такими ознаками: болі носять тривалий характер, загострюються при заворушеннях і менш пов'язані з фізичним навантаженням, локалізуються нема за грудиною, а в області верхівки серця, толерантні до спазмолітичних препаратів, але можуть бути зменшені знеболюючими засобами, відсутні зміни на ЕКГ, спостерігаються ознаки шийного остеохондрозу, напруга і болючість грудних м'язів. З огляду на ці відмінності, слід пам'ятати, що синдром шийної стенокардії, частіше розвиваючись у людей середнього та похилого віку, може поєднуватися з істинною коронарною недостатністю. При корешковом рівні ураження можуть виникати больові симпаталгические феномени в черевній порожнині, імітуючи захворювання внутрішніх органів. Слід зазначити, що органічна патологія вісцеральних систем надає певний вплив на виникнення латералізованние корінцево-сімпаталгіческіе синдромів. Відомо, що останні частіше виникають на шийному рівні зліва. Правобічні ж поразки зазвичай супроводжують патології печінки і жовчних шляхів. Впливають і односторонні легеневі процеси, нирковокам'яна хвороба, хронічний апендицит, патологія яєчників.
Певне місце в вегетологіі займають синдроми, пов'язані з ураженням симпатичної ланцюжка (гангліоніти, трунцити), проте останнім часом стає очевидним, що в клінічній практиці вони зустрічаються досить рідко і описані були, як правило, в «доостеохондрозную еру». Виникнення їх може бути обумовлено спайковимпроцесом, пухлинних і запальних процесів. Локалізація клінічних проявів (симпаталгические і вегетативно-судинні розлади) визначається топікою поразки певних вузлів. Так, при синдромі зірчастого вузла зліва виникає виражений больовий синдром в лівій половині грудної клітини і руці.
Найчастіше зустрічаються синдроми, пов'язані з ураженням вегетативних сплетінь і вузлів, особливо часто втягується в патологічний процес найбільше сплетіння — сонячне. Причиною патології є перш за все спайкові процеси, що виникають при вісцеральних захворюваннях. Клінічна картина солярита складається з перманентних больових і дискинетических порушень в області живота і виникають на цьому тлі загальних вегетативно-судинних пароксизмів, що включають в себе неприємні відчуття і болі в області серця, підйоми артеріального тиску, відчуття браку повітря. Зазначені напади супроводжуються і яскравими емоційними проявами. Є локальна болючість в зонах сонячного сплетення на лінії між мечовиднимвідростком грудини і пупком.
Характерними є і синдроми ураження вегетативних вузлів в області обличчя. Це перш за все залучення крилонебного (синдром Сладера) і носореснічного вузлів (синдром Шарля). Спільними для них є різкі симпаталгические болю в одній половині обличчя, що виникають приступообразно і супроводжуються вегетативними симптомами (сльозотеча і ріноррея) і на стороні больового нападу. Для синдрому Сладера характерні були в області очі, щоки, верхньої та нижньої щелеп, що поширюються на шию і руку відповідної сторони, а також миоклонии м'якого піднебіння. При синдромі Шарль больовий синдром відзначається переважно в області скроні, очі, виникають трофічні порушення на рогівці.
7. Синдром вегетосудинної дистонії при органічному ураженні головного мозку
Практично завжди при будь-яких формах церебральні патології виникають вегетативні порушення, однак вони виражені найбільш яскраво при ураженні глибинних систем мозку (мозкового стовбура, гіпоталамуса і ріненцефалона), що є важливими структурними ланками лімбікоретікулярного комплексу. Зазначені системи позначаються як вегетативні надсегментарні освіти, в яких відсутні специфічні центри, а є інтеграційні мозкові системи, що здійснюють вегетативне забезпечення різних форм поведінки.
При зацікавленості каудальних відділів стовбура мозку найбільш виразно проявляються вестибуловегетативних порушення. В виникають при цьому кризах є дві особливості. Часто початком кризи є запаморочення, а в самому пароксизмі переважають вагоінсулярние прояви. Це ж характерно для перманентних симптомів, що мають місце при цій локалізації патологічного процесу.
При ураженні мезенцефальних структур яскраво проявляються симпатико-адреналової пароксизмальні і перманентні порушення, близькі до тих, які спостерігаються при гипоталамической недостатності. Це пояснюється не тільки топографічної близькістю, але й тісному функціональному зв'язком оральних відділів і гіпоталамуса. Важливе значення для практики має патологія гіпоталамуса, довгий час розглядався як вищий вегетативний центр. В даний час правильніше оцінювати його як важливу ланку лімбікоретікулярного комплексу, інтегративне утворення мозку, що забезпечує взаємодію нервових і гуморальних систем організму. У зв'язку з наявною в практиці тенденцією до гіпердіагностики гіпоталамічних синдромів з'явилася необхідність формулювання діагностичних критеріїв.
Ними є наступні:
1) нейроендокринні синдроми при виключенні первинного ураження периферичних залоз внутрішньої секреції,
2) мотиваційні порушення (голод, спрага , зміни лібідо),
3) нейрогенні порушення терморегуляції,
4) патологічна сонливість пароксизмального характеру. Кожен з виділених критеріїв стає патогномонічним при виключенні ендокринних, вісцеральних і невротичних порушень. Важливо підкреслити, що навіть виражені вегетативні розлади у вигляді вегетативно-судинних кризів (їх часто і неправильно називають діенцефальним) не є достатніми для діагностики гипоталамической патології, проте це не заперечує наявності при гіпоталамічному синдромі яскравих перманентних і пароксизмальних порушень, поєднаних з зазначеними вище патогномонічними проявами . Зазвичай при цьому переважають симпатичні реакції.
Поразка ріненцефальной області проявляється насамперед синдромом скроневої епілепсії. На відміну від всіх описаних досі вегетативних розладів, що носять неепілептіческій характер, вегетативні порушення при скроневої епілепсії можуть входити в модель епілептичного нападу як його аура. Найбільш характерними при цьому є абдомінальні (різкі болі в епігастральній ділянці) або кардіоваскулярні (неприємні відчуття в області серця, аритмії) прояви. Перманентні порушення виражені не різко, часто носять суб'єктивний характер. Переважно переважають вагоінсулярние реакції. Є і поєднані ріненцефально-гіпоталамічні ураження, коли слідом за епілептичної вегетативної аурою розгортається яскравий вегетативний криз, що свідчить про залучення в процес і гіпоталамічної області.
8. Неврози і синдром вегетосудинної дистонії
Неврози частіше за інших причин є чинником, що викликає вегетативні порушення. Пов'язано це з тією обставиною, що неврози є найбільш поширеними захворюваннями, а вегетативні реакції є облігатним їх проявом. Особливий зв'язок вегетативної та емоційної сфер помічена досить давно. Останнім часом це знаходить відображення у формулюванні психовегетативних синдрому. При цьому підкреслюється обов'язковість поєднання зазначених порушень. Однак механізми формування цього синдрому можуть бути різними, так при багатьох з розглянутих раніше факторів первинно можуть виникати вегетативні порушення (патологія внутрішніх органів, сегментарні вегетативні синдроми), а слідом за ними розвиватися і емоційні розлади. Ті й інші прояви можуть виникнути одночасно (патологія надсегментарних утворень, ендокринна вікова перебудова). У разі неврозів можна думати про третій варіант: емоційні порушення є первинними, а вегетативні слідують за ними.
Останні залежать від форми і інтенсивності невротичних розладів. Практично важливо пам'ятати, що в число симптомів, що характеризують вегетосудинну дистонію, входять астенічні, депресивні, фобічні, іпохондричні прояви, порушення сну. Клінічні прояви вегетативних розладів описані в розділі неврозів. Слід підкреслити лише кілька факторів. При неврозах є яскрава перманентна і пароксизмальна дисфункція, що носить або полісистемний, або переважно моносістемний характер. Провідними є симпатико-адреналової прояви.
Таким чином, при виявленні синдрому вегетосудинної дистонії необхідно встановити чинники, які відіграють провідну роль в його генезі. Проведення цього аналізу має першорядне практичне значення, так як визначає терапевтичну тактику лікаря. Виходячи з цього, синдром вегетосудинної дистонії не може фігурувати в якості основного клінічного діагнозу. Приклади правильного формулювання можуть бути наступні: неврастенія, синдром вегето-судинній дистонії, алергія, вестібулоіатія, синдром вегето-судинній дистонії, гіпоталамічний синдром інфекційного генезу, нейроендокринна форма, синдром вегето-судинній дистонії і т. Д.
Лікування включає терапію основних порушень, які є причиною виникнення вегетативних розладів, і вплив на вегетативні прояви.
При конституціональної недостатності і пубертатних порушеннях провідна роль відводиться загальнозміцнюючу і гартують заходів (ЛФК, водні процедури). Якщо в зазначених ситуаціях цей підхід є вирішальним, то слід пам'ятати про необхідність включення загартовування в комплексну терапію всім хворим з синдромом вегето-судинній дистонії.
Лікування основного захворювання необхідно при ураженні внутрішніх і ендокринних органів, клімаксі, алергії. Особливе значення надається нормалізації емоційної сфери, враховуючи психовегетативний характер захворювання. У разі невротичних розладів показані всі форми психотерапії, усунення або дезактуалізація психотравмуючих факторів, своєчасне санаторно-курортне лікування.
Псіхоформакологіческое лікування займає чільне місце. Широко застосовуються при наявності тривоги, страхів, підвищеної дратівливості транквілізатори.
При депресивних порушеннях використовуються антидепресанти. Застосування їх повинно бути диференційованим: в разі тривожної, ажитированной депресії показаний амітриптилін (триптизол), при астенічних формах депресії — имизин (мелипрамин). При виражених іпохондричних тенденції призначають терален, меллерил. Як правило, використовується комбінація декількох препаратів: найчастіше транквілізаторів і антидепресантів. Слід призначати достатні, індивідуально підібрані дози, іноді ефект слабкий через застосування малих доз.
Призначення вегетотропних засобів визначається характером межпріступние симптомів і типом пароксизму. Найчастіше виявляється посилена симпатична активація, що і визначає важливість призначення B-адреноблокаторів (анаприлін, тразикор) і а-адреноблокаторів (пирроксан). Блокуючий ефект на периферії багатодітній родині і гангліоблокатори (ганглерон, пентамін). При посиленою вагоінсулярной активації використовуються холінолітики центральної та периферичної дії (амизил, циклодол) ігангліоблокатори. Чи не втратили свого значення і комплексні препарати: беллоид, белласпон, беллатаминал, які надають нормалізує вплив на обидва відділи вегетативної нервової системи.
Проводиться спеціальне лікування неврологічних захворювань, що визначають виникнення вегетативних розладів — корінцевих проявів остеохондрозу, вестибулопатии, скроневої епілепсії.
Слід підкреслити, що провідну роль в лікуванні вегетосудинної дистонії грає поряд з причинного терапією застосування раціональної психотерапії , психотропних і вегетотропних препаратів.
Новини по темі:
 Російським вченим вдалося вирішити одну з нагальних проблем трансплантології. Це стосується часто використовуваних сьогодні штучних судин, а саме їх схильності утворенню тромбів. Багато серцево-судинні захворювання (особливо, в разі якщо вони були діагностовані на пізніх стадіях) вимагають хірургічного вмешатель
Російським вченим вдалося вирішити одну з нагальних проблем трансплантології. Це стосується часто використовуваних сьогодні штучних судин, а саме їх схильності утворенню тромбів. Багато серцево-судинні захворювання (особливо, в разі якщо вони були діагностовані на пізніх стадіях) вимагають хірургічного вмешатель
сенільна хорея
Морфологічні знахідки схожі із змінами, які виявляються при хореї Гантінгтона. Деякі автори сумніваються в доцільності виділення цієї форми, відносячи подібні випадки до хореї Гантінгтона.
Ішемічний інсульт (інфаркт мозку)
Етіологія ішемічного інсульту
Серед захворювань, що призводять до розвитку інфаркту мозку , перше місце належить атеросклерозу. Нерідко атеросклероз поєднується з цукровим діабетом.
Рідше основним захворюванням, ускладненої інфарктом, є гіпертонічна хвороба, ще рідше — ревматизм. При ревматизмі основною причиною ішемічеcкого інсульту є кардіогенна емболія мозкових судин, значно рідше тромбоваекуліти. Серед інших захворювань, які можуть ускладнюватися ішемічним інсультом, слід згадати артеріїти інфекційної та інфекційно-алергічної природи, захворювання крові (еритремія, лейкози). Аневризми церебральних артерій після їх розриву можуть ускладнитися спазмом і викликати розвиток інфаркту мозку.
Патогенез ішемічного інсульту
Інфаркт мозку формується в основному внаслідок причин, що викликають локальний дефіцит артеріального кровотоку. З факторів, безпосередньо викликають зниження мозкового кровотоку і розвиток інфаркту мозку, слід зазначити стеноз і оклюзію екстракраніальних і інтракраніальних судин мозку. Стеноз і оклюзія при ангіографії виявляються в мозкових судинах рідше, ніж в екстракраніальних, проте клініко-анатомічні повідомлення з цього питання не є однозначними. Деякі автори констатують більш часте ураження окклюзірующего процесом сонних артерій [Шмідт Є. В., 1963, Колтовер А. І., 1975], інші — внутрішньочерепних судин [Левін Г. 3., 1963].
Можна вважати доведеним, що не існує безпосередній кореляції між частотою веріфіцированного стенозу і оклюзії екстра-та інтракраніальних артерій і частотою розвитку ішемічного інсульту. Про це свідчать ангиографические і клініко-морфологічні дані про відносно частому виявленні безсимптомних стенозов і оклюзії.
Таким чином, очевидно, що атеросклеротичні зміни в екстра-та інтракраніальних судинах не обов'язково тягнуть за собою розвиток інфаркту мозку, і навіть при виникненні останнього далеко не завжди встановлюється безпосередня причинно-наслідковий і тимчасова зв'язок (з розвитком атеросклерозу).
Істотна роль в компенсації дефіциту кровообігу при стенозі і оклюзії екстра-та інтракраніальних артерій належить колатерального кровообігу, ступінь розвитку якого індивідуальна.
[ Рис.1 ] [ Рис.2 ] [ Рис.3 ] [ Рис.4 ] [ Рис.5 ]
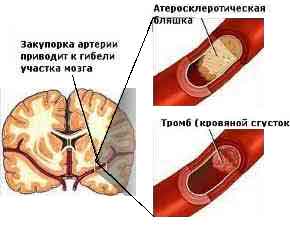
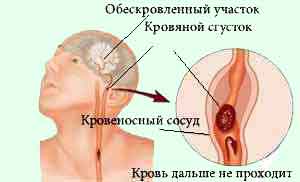
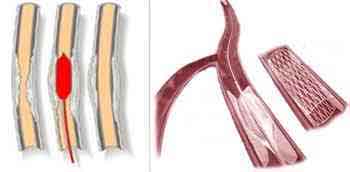
[Рис. 2] Закупорка судини тромбом і атеросклеротичної бляшкою.
Оклюзія судини може бути викликана тромбом, емболом або обумовлена облітерацією його . При наявності повної закупорки судини (екстракраніального, інтракраніальних або интрацеребрально) інфаркт мозку може не розвинутися, якщо добре розвинене колатеральний кровообіг і що особливо важливо, якщо колатеральна мережу швидко включилася з моменту оклюзії судини. Іншими словами розвиток інфаркту мозку при наявності повної оклюзії судини залежить від ступеня розвитку і темпу включення колатеральногокровообігу.
При розвитку стенозу екстракраніальних або інтрацеребральних судин створюються також умови для локальної ішемії речовини мозку , якщо раптово падає АТ . Падіння тиску може бути викликане інфарктом міокарда, кровотечею і т. Д. Крім цього при стенозі судин створюються умови для турбулентного руху крові, що сприяє склеюванню формених елементів крові — еритроцитів і тромбоцитів і утворенню клітинних агрегатів — мікроемболіі, що можуть закрити просвіт дрібних судин і бути причиною припинення кровотоку до відповідної ділянки мозку. Крім того, високий артеріальний тиск (200 / / 100 мм рт. Ст. І вище) розцінюється як несприятливий фактор, що сприяє постійної микротравматизации інтими артерій і відриву емболіческіх фрагментів ізстенозіроваяних ділянок.
Крім тромбозу, емболії, гемодинамічних чинників, а також артеріо-артеріальних емболій, в розвитку інфаркту мозку певну роль відіграють реакція судинної системи мозку і формених елементів крові на дефіцит мозкового кровообігу, а також енергетичні запити тканини мозку .
Реакція судинної системи мозку на зменшення локального мозкового кровотоку різна. Так, в одних випадках ішемія змінюється надмірною кровотоком, що призводить до фільтраційного перифокальний набряку, в інших — зону ішемії оточують розширені судини, але не заповнені кров'ю (феномен «непоновлення» кровотоку). Механізм настільки різної реакції мозкових судин у відповідь на ішемію до кінця не ясний. Можливо це залежить від різного ступеня гіпоксії і змінюються в зв'язку з цим гідродинамічних властивостей крові. Якщо в разі максимального розширення судин з розвиваються регіонарним набряком, що виникають після ішемії, можна думати про зрив нормальних ауторегуляціонних механізмів самих мозкових судин в зоні локальної ішемії, то феномен «непоновлення» кровотоку можна пояснити реакцією тільки одних судин мозку. У механізмі появи порожніх капілярів і артеріол в зоні локального дефіциту кровообігу, мабуть, певну роль відіграють зміни функціональних властивостей клітинних елементів крові, які втрачають здатність в зоні ішемії нормально просуватися по микроциркуляторному руслу.
Відомо, що капілярний кровообіг залежить від агрегаційну властивостей еритроцитів і тромбоцитів, від здатності еритроцитів змінювати свою форму при просуванні через вузькі капіляри, а також від в'язкості крові. Еритроцити крові, мають діаметр, що перевищує діаметр вузьких капілярів, в умовах нормального кровообігу легко змінюють свою форму (деформуються) і подібно амебі просуваються по капілярному руслу. У хворих з судинними захворюваннями здатність змінювати форму у еритроцитів зменшується, вони стають більш жорсткими. Ще більше зниження деформованості червоних кров'яних тілець розвивається в гіпоксичних осередках будь-якої локалізації, де змінюється осмотичний тиск. Значне зниження еластичності еритроцита не дозволить йому пройти через капіляр, діаметр якого менше еритроцита. Отже, збільшення жорсткості еритроцитів, а також збільшення агрегації тромбоцитів і еритроцитів в зоні локальної ішемії мозку можуть бути одним з головних чинників, що перешкоджають притоку крові по розширеним судинах при феномені «непоновлення» кровотоку . Таким чином, якщо причина, яка викликала локальну ішемію мозку, зникає, то країни, що розвиваються після ішемії регіонарний набряк або патологічний феномен «непоновлення» кровотоку можуть привести до порушення нормальної життєдіяльності нейронів і розвитку інфаркту мозку.
Зі сказаного ясно, що як в розвитку оклюзії судин, що живлять мозок (тромбом, емболом, мікроембола) ,. так і при ішемії, що виникла внаслідок гемодинамічних порушень (падіння артеріального тиску, обумовлене різними причинами), важлива роль належить не тільки змін судин, але і фізико-хімічними властивостями крові, від зміни яких залежить результат порушення мозкового кровообігу, т. е. розвиток інфаркту мозку .
У патогенезі церебральних ишемий домінуючу роль серед факторів, що викликають оклюзію, грають тромбози і емболії мозкових судин , розмежування яких представляє значні труднощі не тільки в клініці, але і на аутопсії. Тромб нерідко є субстратом, емболізірующім артерії мозку, що знайшло відображення в широкому використанні терміна «тромбоемболія».
Формуванню тромбу в ураженому посудині сприяють (за існуючими в даний час уявленням) додаткові, або «реалізують тромбоз», чинники. Основними з них слід вважати зміни функціональних властивостей тромбоцитів і (активності біологічно активних моноаминов, порушення рівноваги згортають і противосвертиваючих факторів крові, а також зміни гемодинамічних показників.
Зміни функціонального стану тромбоцитів (підвищення їх агрегаційної і адгезивної здатності, пригнічення дезагрегации) чітко спостерігаються вже в початковій стадії атеросклерозу. Достовірно підвищується агрегація в міру прогресування атеросклерозу з появою минущих порушень мозкового кровообігу і при стенотичних процесах в магістральних артеріях голови. Локальна схильність до агрегації, склеювання, а потім розпаду (віскозному метаморфозу) тромбоцитів на ділянці, де пошкоджена інтиму, пояснюється тим, що саме в цьому місці розвивається ланцюгова реакція, що залежить від ряду гуморальних і гемодинамічних факторів.
Порушення цілісності інтими і оголення колагенових волокон знижують негативний електричний заряд судинної стінки і відповідно зменшують адсорбцію плазмового фібриногену на цій ділянці. Накопичення фібриногену в свою чергу знижує електричний потенціал тромбоцитів і створює умови для їх прилипання до пошкодженої інтимі і швидкого руйнування. При цьому вивільняється ряд прокоагулянтних факторів пластинок, що сприяють прискоренню перетворення протромбіну в тромбін, фібриногену в фібрин і ретракції фібрину. Одночасно має місце пригнічення місцевої фібринолітичної активності плазми, локальна поява тромбіну. Для масивного тромбоутворення, різко обмежує просвіт судини і опиняється причиною ішемічного інсульту, недостатньо тільки тромбогенної активності розпалися тромбоцитарних агрегатів. Вирішальне значення має порушення нормального співвідношення плазмових тромбогенних і антітромбогенних факторів, що утворюються в ураженій ділянці судини.
Безпосередньо в першу добу розвитку ішемічного інсульту виникає підвищення згортання крові в мозковому кровотоці , яке свідчить про утруднення мікроциркуляції і освіті оборотних микротромбов в артеріолах і прекапиллярах мозку. В подальшому наступає захисна протизгортальна реакція, яка, однак, виявляється недостатньою для подолання швидко розвивається генералізованої гіперкоагуляції по всьому судинного русла.
В одночасно протікають процеси тромбоутворення і тромболізису бере участь складний багатоступінчастий комплекс коагулянтной і антикоагулянтних факторів, і в залежності від підсумкового превалювання одного з них в ураженому відрізку судини спостерігаються різні ступені і наслідки тромбоутворення. Іноді процес обмежується стенозом, частковим відкладенням тромбоцитів і фібрину, а іноді-утворюються щільні конгломерати, повністю обтурирующие просвіт судини і поступово збільшуються за довжиною його.
Збільшенню «зростання тромбу» крім гіперкоагулянтності крові сприяють уповільнення кровотоку і турбулентні, вихрові, руху (кров'яних пластинок. Відносна гипокоагуляция робить більш пухкою структуру тромбів, що може з'явитися причиною для утворення клітинних емболій і, мабуть, виявляється чинником, що грає істотну роль в спонтанної реканалізації тромбів. Тромботічеекіе поразки зкстракраніальних і великих інтракраніальних артерій є одним з джерел артеріо-артеріальних емболій судин мозку.
Джерелом емболії мозкових судин може послужити також ураження різних органів і систем. Найбільш часті кардіогенний емболії, що розвиваються внаслідок відриву пристінкових тромбів і бородавчатих нашарувань при клапанних вадах серця, при зворотному ендокардиті, при вроджених вадах серця і під час операцій з приводу вроджених або придбаних пороках серця. Кардіогенний емболії мозкових судин можуть розвиватися при інфарктах міокарду, при гострих постінфарктних аневризмах серця з утворенням пристінкових тромбів і тромбоемболії.
Джерелом емболій можуть з'явитися пристінкові тромби, що утворилися у розпадається атерооклеротіческой бляшки при атеросклерозі аорти та магістральних судин голови. Причиною кардіогенний емболії є різні ураження, що викликають миготливу аритмію і зниження скорочувальної здатності серця (ревматизм, атероаклеротіческій або постінфарктний кардіосклероз, постінфарктний аневризми), а також свіжі інфаркти міокарда, що супроводжуються тромбоендокардіта.
Частота виявлення емболів в артеріальній системі мозку коливається за даними різних авторів від 15 до 74% [Шеффер Д. Г. та ін., 1975, Ziilch, 1973]. Наведені дані зайвий раз свідчать на користь великих труднощів диференціальної діагностики тромбозів і емболій не тільки прижиттєво, а й на аутопсії.
Певне значення в патогенезі ішемічних інсультів мають психоемоційні стрес-фактори , що призводять і зростаючої секреції катехоламінів, в нормальних умовах є своєрідними каталізаторами симпатико-адреналової системи, що підтримує гомеостатическое рівновагу. Стосовно до розглянутої проблеми слід зауважити, що катехоламіни є потужними активаторами агрегації тромбоцитів. Якщо у здорових осіб катехоламіни лише стимулюють агрегацію тромбоцитів, то у хворих на атеросклероз (при швидкому викиді їх в судинне русло) вони викликають різко підвищену агрегацію і руйнування тромбоцитів, що призводить до значного виходу серотоніну, головним переносником якого є тромбоцити [Haft, 1972], і внутрисосудистому тромбоутворення. Гиперпродукцию катехоламінів багато дослідників розглядають як сполучна ланка між психогенними факторами — хронічним або гострим емоційним напруженням і атеросклеротичними змінами судинної стінки [Haft, 1972, Fani, 1973].
В компенсації дефіциту мозкового кровообігу грає роль не тільки індивідуально розвинена мережа колатеральногокровообігу, а й вікові особливості енергетичних запитів тканини мозку. У міру старіння організму і появи біохімічних і клінічних ознак атеросклерозу зменшується маса мозку і інтенсивність мозкового кровообігу. До 60 років інтенсивність мозкового кровотоку, споживання мозком кисню і глюкози зменшується на 20-60% в порівнянні з показниками у здорових молодих людей і при цьому може не виникати помітних порушень функції [Quandt, 1971]. Відносна компенсація церебральної гемодинаміки без появи неврологічної симптоматики може спостерігатися у хворих на атеросклероз при досить значному дефіциті (Кровообігу, в умовах хронічної ішемії, яка характеризується зменшенням загального кровотоку до 36,4 мл (с / 100 г мозку) при нормі 58 мл (с / 100 г ) і споживання кисню до 2,7 мл (замість 3,7 мл). в окремих спостереженнях неврологічні симптоми виявляються оборотними навіть в умовах зниження рівня метаболізму нервових клітин на 75-80% [Quandt, 1974].
Жвава дискусія ведеться при обговоренні ролі спазму церебральних судин в генезі ішемічеокого інсульту і ПНМК. Можливість ангиоспазма мозкових артерій і артеріол в даний час не викликає сумнівів. У нормальних умовах ангіоспазм є звичайною компенсаторну реакцію у відповідь на зниження мозкового кровотоку, на підвищений вміст кисню і знижену концентрацію вуглекислоти в крові. Відповідно до сучасних уявлень, центральний ангіоспазм викликається багатьма гуморальними механізмами. З гуморальних факторів спазмогенну властивості мають катехоламіни, адренокортикотропний гормон, продукти розпаду тромбоцитів. Спазмогенну дією володіють простогландини, переважно фракція Е, що вивільняється головним чином із зруйнованих тромбоцитів.
Ангіоспазм мозкових судин — важлива ланка системи ауторегуляції мозкового кровообігу. Більшість дослідників висловлюють сумніви тому, що до останнього часу ніхто не почув прямих доказів ролі нейрогенного спазму в розвитку інфаркту мозку. Винятком може слугувати спазм, що ускладнює перебіг субарахноїдального крововиливу, який розвивається у відповідь на розрив судинної стінки і призводить до розвитку інфаркту мозку. Однак розвиток спазму артерій при субарахноїдальний крововилив пов'язують з безпосереднім впливом вилилась крові на симпатичні сплетення артерій.
Патологічна анатомія ішемічного інсульту
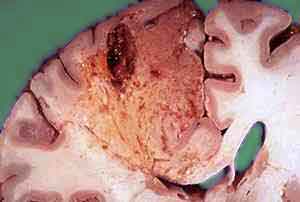
При ішемічному інсульті утворюються інфаркти, т. Е. Осередки некрозу мозку, обумовлені недостатнім притоком крові. У ранні терміни ішемічного інсульту морфологічно виявляється область побледнения і набухання речовини мозку, нечітка структура перифокальною зони.
Межі інфаркту недостатньо рельєфні. Мікроскопічні дослідження виявляють явища набряку мозку і некротичні зміни в нервових клітинах. Нейрони набряклі, погано пофарбовані клітини різко змінені. Залежно від інтенсивності аноксии в більшій чи меншій мірі уражаються макро- і мікроглії, що служить підставою до виділення неповного або повного некрозу мозкової тканини. У більш пізні терміни в області інфаркту виявляється розм'якшення — сіра, кришаться маса.
Клініка ішемічного інсульту
Ішемічний інсульт розвивається найбільш часто у осіб похилого та середнього віку, але іноді може спостерігатися і у більш молодих людей. Розвитку інфаркту мозку нерідко передують ПНМК, які проявляються нестійкими осередковими симптомами. ПНМК частіше локалізуються в тому ж судинному басейні, в якому пізніше розвивається інфаркт мозку.
Ішемічний інсульт може розвиватися в будь-який час доби . Нерідко він виникає під час вона або відразу після нього. В окремих випадках ішемічний інсульт розвивається -після фізичного навантаження, прийому гарячої ванни, вживання алкоголю, рясного прийому їжі. Нерідко спостерігається виникнення ішемічного інсульту після психоемоційного перенапруження.
Найбільш характерно для ішемічного інсульту поступовий розвиток вогнищевих неврологічних симптомів , яке відбувається, як правило, протягом 1-3 ч і значно рідше протягом 2-3 доби. Іноді спостерігається мерехтливий тип розвитку симптомів, коли ступінь вираженості їх то посилюється, то слабшає або на короткий період часу зникає зовсім.
Крім типового, повільного, поступового розвитку вогнищевих симптомів інфарктів мозку в 1/3 випадків спостерігається гострий, раптове, блискавичне (апоплектиформное, їх виникнення, характерне для гострої закупорки великої артерії, при цьому, як правило, вогнищеві симптоми відразу ж максимально виражені і поєднуються з загальмозкові симптоматикою. Значно рідше спостерігається псевдотуморозная розвиток, коли осередкові симптоми інфаркту мозку посилюються протягом декількох тижнів, що обумовлено наростанням окклюзірующего процесу в судинах мозку.
Характерною особливістю ішемічного інсульту є переважання вогнищевих симптомів над загальномозковими. Загальмозкові симптоми — головний біль, блювота, сплутана свідомість спостерігаються найчастіше при апоплектиформна розвитку і можуть наростати в міру збільшення набряку мозку, що супроводжує обширний інфаркт мозку. Осередкові симптоми залежать від локалізації мозкового інфаркту. На підставі клінічного оімлтомокомплекса можна судити про величину, локалізації інфаркту та про судинному басейні, в руслі якого він розвивається. Найбільш часто інфаркти мозку виникають в басейні внутрішніх сонних артерій. Частота інфарктів в системі внутрішніх сонних артерій перевищує частоту інфарктів в вертебробазилярном басейні в 5-6 разів.
Інфаркти в басейні внутрішньої сонної артерії.
Внутрішня сонна артерія часто уражається атеросклеротичним процесом, причому атеросклеротический стеноз і тромбоз частіше виникає в області біфуркації каротид, в синусі внутрішньої сонної артерії або в області сифона. Рідше оклюзія розвивається в загальній сонній або зовнішньої сонної артерії.Стеноз і навіть повна закупорка внутрішньої сонної артерії може не супроводжуватися розвитком інфаркту мозку, якщо оклюзія локалізується екстракраніального, на шиї. В цьому випадку повноцінний артеріальний коло великого мозку здійснює заместительное кровообіг з внутрішньої сонної артерії іншої сторони або з хребетних артерій. При дефектності колатеральногокровообігу стенозуючих поразку екстракраніального відділу внутрішньої сонної артерії в початковому періоді протікає нерідко у вигляді ПНМК, клінічно виражаються короткочасної слабкістю в кінцівках, онімінням в них, афатічеекімі розладами, зниженням зору на одне око.
При интракраниальной оклюзії (тромбозі) внутрішньої сонної артерії, що протікає з роз'єднанням артеріального кола великого мозку, розвиваються геміплегія і грубо виражені загальномозкові симптоми — розлад свідомості, головний біль , блювота, з подальшим порушенням вітальних функцій, обумовленим сдавленней і зміщенням ствола бурхливо розвиваються набряком мозку. Інтракраніальна оклюзія внутрішньої сонної артерії нерідко закінчується летально.
У зоні васкуляризації передньої мозкової артерії великі інфаркти розвиваються рідко. Вони можуть спостерігатися при закупорці основного стовбура передньої мозкової артерії після відходження від неї передній сполучної артерії.
Клінічна картина при інфарктах в басейні передньої мозкової артерії характеризується спастичним геміпарез протилежних кінцівок з переважним розвитком парезу в проксимальному відділі руки і дистальному відділі ноги. Може відзначатися затримка сечі. З патологічних стопного рефлексів з великою постійністю викликаються рефлекси сгибательного типу — Россолимо, Бехтерева, а також спостерігаються хапальний рефлекс і рефлекси орального автоматизму. Іноді виявляються негрубі розлади чутливості на паралізованою нозі. Внаслідок ішемії додаткової мовної зони на медіальної поверхні півкулі можливий розвиток дизартрії, афонії і моторної афазії.
При осередках інфаркту в басейні передньої мозкової артерії відзначаються порушення психіки, зниження критики, пам'яті, елементи невмотивованого поведінки. Зазначені вище порушення психіки грубіше виражені при двосторонніх осередках інфарктів в басейні передніх мозкових артерій.
Найчастіше в басейні передніх мозкових артерій розвиваються невеликі інфаркти, зумовлені ураженням гілок передньої мозкової артерії. Так, при оклюзії парацентральной гілки розвивається монопарез стопи, що нагадує периферичний парез, а при ураженні околомозолістой гілки виникає лівостороння апраксія. Поразка премоторной області з провідними шляхами в цій зоні викликає грубе підвищення м'язового тонусу, значно перевершує ступінь парезу, і різке підвищення сухожильних рефлексів з патологічні рефлекси сгибательного типу.
Найбільш часто інфаркти розвиваються в басейні середньої мозкової артерії , яка може бути уражена в області основного стовбура до атхожденія глибоких гілок, після їх відгалуження і в області окремих гілок, що і визначає клінічну картину інфаркту в кожному конкретному випадку.
При оклюзії основного стовбура середньої мозкової артерії спостерігається обширний інфаркт, що приводить до розвитку геміплегії, гемігіпестезія в протилежних вогнища інфаркту кінцівках і гемианопсии. При ураженні лівої середньої мозкової артерії, т. Е. При левополушарной локалізації інфаркту, розвивається афазія, частіше тотальна, при правопівкульних інфарктах в зоні васкуляризації середньої мозкової артерії спостерігається анозогнозия (неусвідомлення дефекту, ігнорування паралічу та ін.).
Інфаркт в басейні глибоких гілок середньої мозкової артерії викликає спастическую геміплегію, іноді з порушенням чутливості і моторну афазію при осередках в лівій півкулі.
Поразка корково-підкіркових гілок призводить до розвитку геміпарезу з переважним порушенням рухів в руці, розладу всіх видів чутливості, гемианопсии, а також сенсорно-моторної афазії, порушення письма, рахунку, читання, праксису (при левополушарной локалізації інфаркту) і анозогнозии і розладу схеми тіла при локалізації інфаркту в правій півкулі.
У басейні задніх гілок середньої мозкової артерії інфаркт проявляється синдромом ураження тім'яно-вісочнозатилочвой області — гемігіпестезіей, порушенням глибокої чутливості, Астереогноз, аферентним парезом кінцівок, гемианопсией, а при левополушарной локалізації процесу -Сенсорний афазією, аграфією, акалькулией і апраксией.
Інфаркти в басейні окремих гілок середньої мозкової артерії виражаються менш грубою симптоматикою: при ураженні роландовой артерії спостерігається гемипарез з переважанням слабкості в руці, при інфаркті в руслі задньої тім'яної артерії відзначається гемігіпестезія всіх видів чутливості з розвитком аферентного парезу, а в басейні прецентральной артерії — парез ніжнеміміческой мускулатури, мови і слабкість в кисті, моторна афазія (при ураженні домінантної півкулі).
При порушенні кровообігу в судинах вертебробазилярного басейну спостерігаються системне запаморочення, порушення слуху і зору, напади раптового падіння, вегетативні розлади, іноді виникають кома, тетраплегія, порушення дихання і серцевої діяльності, дифузна гіпотонія або горметония.
Інфаркт при оклюзії хребетної артерії призводить до розвитку симптомів з боку довгастого мозку, мозочка і частково шийного відділу спинного мозку. Вогнища інфаркту при закупорці хребетної артерії можуть розвиватися не тільки в області мозочка і довгастого мозку, а й на віддалі, в області середнього мозку, в зоні суміжного кровообігу, двох судинних систем — хребетного і каротидного басейнів. Інфаркти в зоні суміжного кровообігу більш характерні для оклюзії екстракраніального відрізка хребетної артерії. Можливий розвиток згаданих вище нападів раптового падіння з втратою м'язового тонусу (drop attace), а також вестибулярних порушень (запаморочення, атаксія, ністагм), мозочкових розладів координації та статики, окорухових розладів, рідко — зорових порушень.
Для оклюзії интракраниального відділу хребетної артерії характерні синдроми Валленберга-Захарченко, Бабинського-Нажотта і інші синдроми ураження нижніх відділів стовбура. Інфаркти в басейні гілок хребетної артерії, що живлять довгастий мозок і мозочок, супроводжуються найчастіше розвитком синдрому Валленберга-Захарченко, обумовленого ураженням нижньої задньої мозочкової артерії -найвищої великої гілки хребетної артерії.
Клінічно на стороні інфаркту відзначаються параліч м'язів глотки, м'якого піднебіння, гортані (внаслідок чого розвиваються дисфагія і дисфонія), мозочкова атаксія (динамічна і статична зі зниженням м'язового тонусу), синдром Горіера (внаслідок ураження гіпоталамоспінального симпатичного шляху), гіпестезія больової і температурної чутливості на половині обличчя, що відповідає за поразки, і на протилежній половині тулуба, обумовлена поразкою спинального спадного корінця трійчастого нерва і спіноталаміческого шляху.
Симптоми ураження пірамідного шляху, як правило, відсутні або виражені слабо. Частими симптомами оклюзії нижньої мозочкової артерії є запаморочення, блювота, ністагм, пов'язані з ураженням вестибулярних ядер. Існує кілька варіантів синдрому Валленберга-Захарченко, обумовлених різною кількістю гілок задньої нижньої артерії мозочка, а також індивідуальними особливостями колатеральногокровообігу.
При окклюзирующих процесах в хребетних артеріях розвивається близький до синдрому Валленберга-Захарченко синдром Бабинського-Нажотта (параліч піднебінної фіранки при схоронності функції голосових зв'язок, перехресний геміпарез з гемігіпестезіей диссоциированного характеру і мозочкова атаксія на боці вогнища).
Інфаркти в області моста мозку можуть бути викликані окклюзией як гілок основної артерії, так і головного її стовбура. Інфаркти в області гілок основної артерії відрізняються великим поліморфізмом клінічних проявів, геміплегія контралатеральних кінцівок поєднується з центральним паралічем лицьового і під'язикового нервів і з мостовим паралічем погляду або з паралічем відвідного нерва на стороні поразки. Може спостерігатися на стороні вогнища і периферичний парез лицьового нерва (альтернирующий синдром Фовіля). Можлива альтернирующая гемігіпестезія-порушення больової і температурної чутливості на обличчі на стороні інфаркту і на протилежній половині тулуба.
Двосторонні інфаркти в області моста викликають розвиток тетрапареза, псевдобульбарного синдрому і мозочкових симптомів.
Оклюзія основної артерії призводить до розвитку обширного інфаркту з симптомами ураження моста мозку, мозочка, середнього мозку і гіпоталамуса, а іноді і корковими симптомами з боку потиличних часток мозку.
Гостро виникла закупорка основної артерії призводить до розвитку симптомів перш за все з боку середнього мозку і моста мозку — розвиваються розлад свідомості, окорухові порушення, обумовлені ураженням III, IV , VI пар черепних нервів, тетраплегія, порушення м'язового тонусу, двосторонні патологічні рефлекси, тризм нижньої щелепи, гіпертермія та порушення вітальних функцій. У переважній кількості випадків оклюзія основної артерії закінчується летально.
Середній мозок кров'ю артеріями, що відходять від задніх мозкових і основний артерій. При інфаркті в басейні цих артерій спостерігається нижній синдром червоного ядра — параліч окорухового нерва на стороні вогнища, атаксія і интенционное тремтіння в контралатеральних кінцівках за рахунок ураження верхньої мозочкової ніжки поблизу червоного ядра (на ділянці від перехрещення Вернекінга до червоного ядра) або самого червоного ядра. При ураженні передніх відділів червоного ядра можуть бути відсутні симптоми з боку окоруховогонерва, але спостерігатися хореоформний гиперкинез.
При інфаркті в басейні четверохолмной артерії розвивається параліч погляду вгору і парез конвергенції (синдром Паріно), іноді поєднується з ністагмом. Інфаркт в області ніжки мозку викликає розвиток синдрому Вебера.
Інфаркт в басейні задньої мозкової артерії виникає як у зв'язку з оклюзією самої артерії або її гілок, так і при ураженні основної або хребетної артерій. Ішемія в басейні кірки про — під кор ков и х гілок задньої мозкової артерії може захопити потиличну частку, III і частково II скроневі звивини, базальні і медіально-базальні звивини скроневої частки (зокрема, гіппокамповой звивину). Клінічно розвивається гомонимная гемианопсия з збереженням макулярного (центрального) зору, ураження кори потиличної області (поля 18, 19) може привести до зорової агнозии і явищ метаморфопсії. При л евополушарних інфарктах ib басейні задньої мозкової артерії можуть спостерігатися алексія і легко виражена сенсорна афазія. При поширенні ішемії на гіппокамповой звивину і маміллярних тіла виникають розлади пам'яті типу корсаковского синдрому з переважним порушенням короткочасної пам'яті на поточні події, при збереженні пам'яті на віддалені минулі події.
Поразка задненіжніх відділів кори тім'яної області на кордоні з потиличної призводить до порушення оптико-просторового Гнозис, дезорієнтація в місці і часу. Можливий розвиток і емоційно-афективних порушень у вигляді тривожно-депресивного синдрому, стану психомоторного збудження з нападами страху, гніву, люті.
При формуванні постішеміческіх вогнищ судомної активності розвивається скронева епілепсія, що характеризується поліморфізмом епілептичних пароксизмів, спостерігаються великі епілептичні припадки, абсанси, психічні еквіваленти та ін.
При інфаркті в басейні глибоких гілок задньої мозкової артерії (a. thalamogeniculata) розвивається таламический синдром Дежерина-Русею — гемианестезия, гиперпатия, тимчасовий геміпарез, геміавопеія, гемиатаксия, а інфаркт в басейні a. thalamoperforata клінічно характеризується розвитком важкої атаксії, хореоатетоз, «таламической руки» і интенционного тремору в контралатеральних кінцівках. При ураженні дорсомсдіалиюго ядра зорового бугра іноді розвивається акінетичний мутизм. У перші дні ішемічного інсульту температурної реакції і суттєвих зрушень в периферичної крові, як правило, не спостерігається. Однак при великих інфарктах з вираженим набряком мозку з залученням в процес мозкового стовбура можливий розвиток гіпертермії і лейкоцитозу, а також підвищення вмісту цукру і сечовини в периферичної крові.
З боку системи згортання і протівоовертивающей системи крові у більшості хворих на ішемічний інсульт відзначається зрушення в бік гіперкоагуляції крові. Підвищення фібриногену, протромбіну, толерантності плазми до гепарину, поява фібриногену В при зниженою або нормальною фібрінолітічеокой активності зазвичай виражено в перші 2 тижні захворювання. У ряді випадків можлива зміна гіперкоагуляції крові гіпокоагуляцією. При цьому відзначається (раптове падіння рівня фібриногену в крові, зменшення протромбінового індексу і зниження кількості тромбоцитів. Перераховані плазмові (фиб «ріноген, протромбін) і клітинні фактори згортання крові споживаються на внутріеоеудістое згортання, а позбавлена факторів, що згортають кров проникає через судинну стінку, викликаючи геморагічні ускладнення. Розвиваються поширені геморагічні ускладнення, які є наслідком внутрішньосудинного згортання (синдром споживання, тромбогеморрагіческій синдром, синдром діесемінірованного внутрішньосудинного згортання).
У хворих з ішемічним інсультом в гострому періоді відзначається достовірно висока агрегація і адгезивність тромбоцитів. На найбільш високих цифрах вона тримається протягом 10-14 днів, повертаючись до субнормальний показниками на 30-й день інсульту. Спинномозкова рідина зазвичай прозора з нормальним вмістом білка і клітинних елементів. Можливе невелике збільшення білка і лімфоцітарвого цитоза при осередках інфаркту, що межують з лікворних простором і викликають реактивні зміни в епендими шлуночків і мозкових оболонках.
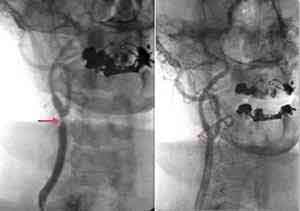
Ехоенцефалографія при ішемічному інсульті зазвичай не вказує зміщення серединного М-еха сигналу. Однак при великих інфарктах в зв'язку з розвитком набряку і зміщенням стовбура мозку можуть спостерігатися зміщення М-еха вже до кінця першої доби з моменту розвитку інфаркту. Ультразвукова флюорометрія (метод Доплера) дозволяє виявити оклюзію і виражені стенози магістральних артерій голови. Важливу інформацію дає ангіографія, яка виявляє у хворих на інфаркт мозку наявність або відсутність окклюзірующего і стенозирующего процесів в екстра-та інтракраніальних судинах головного мозку, а також функціонують шляху колатерального кровообігу. На ЕЕГ виявляються міжпівкульна асиметрія і іноді вогнище патологічної активності. Характерні зміни при інфаркті мозку виявляє комп'ютерна томографія, яка виявляє вогнище зниженої щільності паренхіми мозку в зоні інфаркту та периинфарктной області на відміну від змін, які виявляються при крововиливі в мозок, коли томографія виявляє протилежні зміни — вогнище підвищеної щільності.
Діагноз ішемічного інсульту
У більшості випадків діагностувати інсульт не представляє великих труднощів. Гостре розвиток вогнищевих і загальномозкових симптомів у пацієнтів зрілого та похилого віку, які страждають на атеросклероз або гіпертонію, а також у молодих осіб на тлі системного судинного захворювання або хвороби крові, як правило, вказує на гостре порушення мозкового кровообігу — інсульт або ПНМК. Однак завжди слід мати на увазі захворювання, що викликають церебральні порушення, які не є наслідком ураження судинної системи, з якими необхідно диференціювати інсульт.
До їх числа відносяться:
- черепно-мозкова травма в гострому періоді (контузія мозку , травматичні подоболочечние крововиливи),
- інфаркт міокарда, що супроводжується порушенням свідомості,
- пухлини головного мозку з апоплектиформна розвитком, обумовленим крововиливом в пухлину,
- епілепсія, при якій розвиваються постпріпадочной паралічі,
- гіпер- або гіпоглікемічна кома,
Особливо скрутний диференційний діагноз в тих випадках, коли у хворого є розлад свідомості. Якщо хворий виявлено в ситуації, при якій можна припускати травму, він повинен бути ретельно оглянутий з метою встановлення саден на голові і на тілі, після чого необхідна термінова рентгенографія черепа, ехоенцефалографія і дослідження спинномозкової рідини. При епі- і субдуральних гематомах травматичного походження порушення цілості кісток черепа, зміщення серединного сигналу М-еха, домішки крові в спинномозковій рідині та наявність безсудинного вогнища на ангиограмме дозволяють повністю визначити не тільки характер, але і топіку ураження.
Слід також мати на увазі, що при гострої серцевої слабкості іноді спостерігається порушення свідомості, обумовлене різким зниженням об'ємного мозкового кровотоку і вторинною гіпоксією мозкової тканини. При цьому крім спутаного свідомості відзначаються порушення дихання, блювота, падіння артеріального тиску. Вогнищевих симптомів ураження півкуль і стовбура головного мозку не виявляється, за винятком тих випадків, коли інфаркт міокарда поєднується з розвитком мозкового інфаркту.
Нерідко (особливо в осіб похилого віку) виникають труднощі при диференціації пухлини мозку, ускладненої крововиливом, і судинного процесу. Мультиформні сповгіобластоми можуть протікати деякий час латентно, і перші прояви їх виникають в результаті крововиливу в пухлину. Лише подальший перебіг з наростанням симптомів ураження головного мозку дозволяє розпізнати пухлину. Діагноз епілепсії, гіпер- або гіпоглікемічної коми, а також уремії підтверджується або відкидається на підставі уточнених анамнестичних відомостей, кількості вмісту цукру і сечовини в крові, аналізу сечі і показників ЕЕГ.
Таким чином, дані анамнезу, клінічних особливостей, дослідження спинномозкової рідини, очного дна, луна і електроенцефалографії, ЕКГ, показники вмісту цукру і сечовини крові, а також рентгенографічні дослідження — краніографія, ангіографія дозволяють правильно диференціювати інсульт від інших апоплектіформ але протікають захворювань.
Відрізнити інфаркт мозку від геморагічного інсульту в ряді спостережень представляє великі труднощі. Проте визначення характеру інсульту необхідно для проведення диференційованого лікування. При цьому слід визнати, що немає окремих (Симптомів, суворо патогномонічних для крововиливи або інфаркту мозку. Раптовий розвиток інсульту, характерне для крововиливи, спостерігається нерідко при оклюзії великої судини, що приводить до розвитку гострого інфаркту мозку. І в той же час при крововиливах, особливо диапедезного характеру, симптоми ураження речовини мозку можуть наростати протягом декількох годин, поступово, що вважається найбільш характерним для розвитку інфаркту мозку.
Добре відомо, що під час сну розвивається, як правило, інфаркт мозку, проте хоча і багато рідше, але і крововиливи в мозок можуть відбуватися вночі. Виражені загальномозкові симптоми, такі характерні для крововиливи в мозок, нерідко спостерігаються при великих інфарктах мозку, що супроводжуються набряком. Артеріальна гіпертонія частіше ускладнюється крововиливом, однак супутній гіпертонії атеросклероз нерідко є причиною розвитку інфаркту, спостерігається часто у хворих, які страждають на атеросклероз з артеріальною гіпертензією. Високі цифри артеріального тиску в момент інсульту не завжди слід розглядати як його причину, підвищення артеріального тиску може бути і реакцією стволового судинного центру на інсульт.
З наданого видно, що окремі симптоми мають відносну діагностичну цінність для визначення характеру інсульту. Однак певні поєднання симптомів з даними додаткових досліджень дозволяють правильно розпізнати характер інсульту в переважній більшості випадків. Так, розвиток інсульту уві сні або відразу після сну на тлі серцевої патології, особливо що супроводжується порушенням ритму серцевої діяльності, інфаркт міокарда в анамнезі, помірна артеріальна гіпертонія — характерні для ішемічного інсульту. А початок інсульту з гострого головного болю, повторних рвот днем, особливо в момент емоційного напруження у хворого, який страждає на гіпертонічну хворобу, порушення свідомості найбільш характерні для крововиливи в мозок. При цьому необхідно врахувати, що лейкоцитоз із зсувом вліво, з'явився в першу добу інсульту, підвищення температури тіла і наявність крові або ксантохроміі в спинномозковій рідині, зміщення М-еха і наявність вогнища підвищеної щільності при комп'ютерній томографії вказують на геморагічний характер інсульту.
Приблизно в 20% спостережень макроскопически спинномозкова рідина при крововиливі буває прозорою і безбарвною. Однак мікроскопічне дослідження у цій категорії хворих дозволяє виявити еритроцити, а спектрофотометром виявляють пігменти крові (білірубін, окси- і метгемоглобін). При інфаркті рідина безбарвна, прозора, можливе підвищення вмісту білка. Дані коагулограми, а також ЕЕГ і РЕГ достовірно не підтверджують характер інсульту. Інформативним методом слід визнати ангіографію, проте артеріографіческіе дослідження через небезпеку ускладнень рекомендують проводити в тих випадках, коли є доцільність хірургічного лікування. В даний час найбільшою значущістю при визначенні характеру інсульту мають дані комп'ютерної томографії, що дозволяє виявити осередки різної щільності при інфаркті мозку і крововилив в мозок.
Геморагічний інфаркт відноситься до числа найбільш важко діагностованих станів. Щодо механізму розвитку геморагічних інфарктів серед патоморфології і патофізіологів поки немає єдності поглядів. При геморагічному інфаркті спочатку розвивається ішемічне ураження, а потім (або одночасно) з'являється крововилив в інфарктну зону.
Геморагічні інфаркти відрізняються від іншої форми порушення мозкового кровообігу — геморагічного диапедезного просочування як за механізмом розвитку, так і по морфологічних змін [Колтовер А. Н., 1975]. Найчастіше геморагічні інфаркти локалізуються в сірій речовині, корі головного мозку, підкіркових гангліях і зоровому горбі. Розвиток геморрагий в осередку ішемії більшість дослідників пов'язують з раптовим наростанням кровотоку в ішемічної зоні через швидке припливу крові в цю область за коллатералям.
Геморагічні зміни частіше бувають при великих, швидко формуються інфарктах мозку.
За розвитком захворювання і клінічними проявами геморагічний інфаркт нагадує геморагічний інсульт — крововилив в мозок по типу гематоми або по типу геморагічного диапедезного просочування, тому геморагічний інфаркт діагностується за життя значно рідше, ніж на розтині.
Лікування ішемічного інсульту
Система лікування будується на підставі тих уявлень про патогенез мозкового інсульту, які склалися за останні роки. Вона включає комплекс лікувальних заходів невідкладної допомоги хворим з мозковим інсультом, незалежно від його характеру (недиференційована допомогу) і диференційоване лікування інфаркту мозку.
Недиференційована терапія спрямована на нормалізацію життєво важливих функцій — дихання і серцевої
діяльності. До неї відносяться — боротьба з набряком мозку, гіпертермією, а також профілактика ускладнень інсульту. Перш за все необхідно забезпечити вільну прохідність дихальних шляхів за допомогою спеціальних відсмоктувачів, ротових та носових воздуховодов, протирання ротової порожнини хворого, утримування нижньої щелепи. У разі, якщо заходи, спрямовані на усунення закупорки дихальних шляхів, виявляються неефективними, виробляють інтубацію і трахеостомию.
Інтубацію або трахеостомию використовують при раптовій зупинці дихання, прогресуючому розладі дихання, при бульбарної і псевдобульбарной симптоматиці, коли є небезпека аспірації . При раптовій зупинці дихання і відсутності апарату необхідно робити штучне дихання з рота в рот, з рота в ніс.
При супутньому набряку легенів показані кардиотоники: вводять 1 мл 0,06% розчину коргликона або 0,5 мл 0,05% розчину строфантину в / в. Крім вищевказаних коштів рекомендується вдихання кисню з парами спирту через кисневий інгалятор або апарат Боброва з метою зменшення піноутворення в альвеолах. Інгаляції парів спирту тривають протягом 20-30 хв, потім повторюються після 20-хвилинної перерви.
Піднімають головний кінець ліжка з метою надання піднесеного положення хворому. Призначають фуросемід (лазикс) в / м, димедрол, атропін. При різкому падінні артеріального тиску призначають 1 мл 1% розчину мезатону, 1 мл 0,06% розчину коргликона, 1 мл 0,1% розчину норадреналіну, 0,05 г гідрокортизону з 5% розчином глюкози або розчином бікарбонату натрію в / в крапельно зі швидкістю 20-40 крапель в хвилину. Інфузійну терапію слід проводити під контролем показників кислотно-лужної рівноваги та електролітного складу плазми.
Компенсація водно-електролітного балансу і корекція кислотно-лужної рівноваги проводяться у хворих, що знаходяться в несвідомому стані. Необхідно вводити парентерально рідини в обсязі 2000-2500 мл на добу в 2-3 прийоми.
Вводять ізотонічний розчин хлориду натрію, розчин Рінгера-Локка, 5% розчин глюкози. Так як порушення кислотно-лужної рівноваги часто супроводжується дефіцитом калію, то необхідно застосовувати нітратну сіль калію або хлорид калію в кількості до 3-5 г на добу. Для усунення ацидозу поряд зі збільшенням легеневої вентиляції і оксигенотерапией, а також заходами, що збільшують серцевий викид, вводять в / в 4-5% розчин бікарбонату натрію (200-250 мл).
Заходи, спрямовані на боротьбу з набряком мозку, проводять при великих мозкових інфарктах. У цих випадках призначають фуросемід (лазикс), 1-2 мл ib / m або всередину в таблетках по 0,04 г один раз в день, 5-10 мл 5% розчину аскорбінової кислоти з метою зменшення проникності судинної стінки. Протинабрякову дію мають гідрокортизон і преднізолон, які доцільно призначати протягом перших 2-3 днів в залежності від вираженості набряку мозку. Хороший протинабряковий ефект може бути отриманий при використанні маннита, що є осмотичним діуретиком. Менш бажано застосування сечовини, так як наступає слідом за потужним протинабрякову ефектом викарное розширення судин мозку може привести до повторного ще більш грубому набряку і можливого кровотечі в паренхіму мозку. Дегидратирующим дію має гліцерин, що підвищує осмотичний тиск крові, що не порушує електролітного балансу.
Необхідно застосування засобів, спрямованих на попередження та усунення гіпертермії. При температурі тіла 39 ° С і вище призначають 10 мл 4% розчину амідопірину або 2-3 мл 50% розчину анальгіну в / м. Знижують температуру суміші, що складаються з димедролу, новокаїну, амидопирина. Рекомендується також регіонарна гіпотермія великих судин (бульбашки з льодом на область сонних артерій на шиї, в пахвові і пахові області).
З метою попередження пневмонії необхідно вже з першої доби інфаркту повертати хворого в ліжку через (кожні 2 год, на грудну клітку слід ставити кругові банки, чергуючи їх через день з гірчичниками. При підозрі на розвиток пневмонії призначають сульфаніламідні препарати і антибіотики. Необхідний контроль за діяльністю сечового міхура і кишечника. При затримці сечі показана катетеризація 2 рази на добу з промиванням сечового міхура антисептичними засобами. Щоб уникнути пролежнів, необхідно стежити за чистотою білизни, станом ліжку — усувати складки простирадлом, нерівності матраца, протирати тіло камфорним спиртом.
При лікуванні інфаркту мозку необхідно спрямувати всі зусилля на поліпшення порушеного церебрального кровообігу і спробувати усунути розвинулася ішемію. Це певною мірою вдається зробити за рахунок посилення серцевої діяльності і поліпшення венозного відтоку крові, тому доцільно застосування кардіотонічних засобів, що збільшують ударний і хвилинний об'єм серця, а також поліпшують відтік венозної крові з порожнини черепа (строфантину або коргликона в / в).
Сосудорасширяющие препарати доцільно призначати у вигляді підшкірних або внутрішньом'язових ін'єкцій в тих випадках, коли необхідно добитися гіпотензивного ефекту, знизити дуже високий артеріальний тиск, уникнути небезпеки розвитку геморагічного ускладнення в зоні інфаркту мозку. Уявлення про те, що сосудорасширяющими препаратами можна досягти поліпшення мозкового кровообігу і збільшення локального мозкового кровотоку, в останні роки піддається перегляду. Деякі дослідники висловлюють точку зору про недоцільність і навіть шкідливість застосування вазодилататорів при інфаркті мозку. Ці висловлювання засновані на тому, що в експерименті, а також при ангіографічної вивченні стану судинної системи головного мозку і при дослідженні локального мозкового кровотоку за допомогою радіоактивного ксенону у хворих отримані дані про те, що судини в області ішемії або зовсім не реагують на подразники, або реагують слабо, а іноді навіть парадоксально. Тому звичайні церебральні вазодилататори (папаверин та ін.) Ведуть до розширення лише непостраждалих судин, відтягують на себе кров з області інфаркту. Це явище отримало назву феномена внутрімоз-кового обкрадання.
Судини периинфарктной зони, як правило, бувають максимально розширені (зокрема, внаслідок місцевого ацидозу), а розширення судин непораженной області під впливом судинорозширювальних засобів може зменшити тиск в розширених колатералей і тим самим зменшити кровопостачання ішемізованої області [Olesen, 1974].
З рекомендаціями деяких клініцистів — застосовувати судинорозширювальні засоби в тих випадках, коли в якості основної причини інфаркту передбачається ангіоспазм, важко погодитися, так як причинний залежність інфаркту мозку від ангиоспазма ще не доведена, а на викликає інфаркт мозку ангіоспазм після розриву аневризми папаверин і інші вазоактивні препарати не діють [Кандель Е '1975, Flamm, 1972].
Для поліпшення колатерального кровообігу і мікроциркуляторного ланки в зоні інфаркту мозку доцільно призначати лікарські засоби, що зменшують в'язкість крові і знижують агрегаційні властивості її формених елементів. З цією метою в / в вводять 400 мл низькомолекулярного декстрану — реополіглюкіну. Препарат вводять крапельно, з частотою 30 крапель в хвилину, щодня, протягом 3-7 днів.
Введення реополіглюкіну покращує локальний мозковий кровотік, призводить до антітромбогенному дії. Ефект реополіглюкіну найбільш виражений в артеріолах, прекапиллярах, капілярах.
В результаті різкого зниження агрегації еритроцитів і тромбоцитів зменшується інтенсивність мікроциркуляторного синдрому осадження, що виражається низьким перфузійним тиском, уповільненням кровотоку, підвищеною в'язкістю крові, агрегацією і стазом кров'яних елементів, утворенням тромбів. Через відомого гіперволемічна і гіпертензивної дії реополіглюкіну необхідний контроль за АТ, причому тенденція до артеріальної гіпертензії може бути відрегульована зниженням частоти крапель розчину, що вводиться. Антиагрегаційний ефект реополіглюкіну спостерігається протягом 4-6 год, тому доцільно в інтервалах між введенням реополіглюкіну і після припинення його ін'єкцій рекомендувати перорально аспірин, монобромістую камфору, трентал та ін.
антиагрегаційних ефект може бути досягнутий в / в введенням 10 мл 24% розчину еуфіліну, а також 2 мл 2% розчину папаверину. Похідні аминофиллина, так само як і папаверин, чинять інгібуючу дію на фосфодіестеразу, в силу чого накопичується циклічна, аденозінмонофосфорной кислота в клітинах крові, що є потужним інгібітором агрегації. Регулярний прийом інгібіторів агрегації клітинних елементів крові перорально після п'ятиденного або тижневого застосування їх у вигляді ін'єкцій дозволяє протягом усього гострого періоду інфаркту домогтися надійного попередження тромбоутворення в усій судинній системі в цілому. Прийом інгібіторів агрегації доцільно продовжувати протягом двох років, що є небезпечним періодом для розвитку повторних інфарктів. Застосування антиагрегантів клітинних елементів крові дозволило в останні роки в значній мірі зменшити використання антикоагулянтів, що вимагають для свого застосування регулярного контролю за згортанням крові і протромбінового індексом. У випадках же тромбоемболічного синдрому, на тлі якого розвинувся інфаркт мозку, показано застосування фібринолітичних препаратів з антикоагулянтами.
Антикоагулянтная терапія починається з застосування антикоагулянту прямої дії — гепарину. Гепарин призначають в / в або в / м в дозі 5000-10 000 ОД 4-6 разів на день протягом 3-5 днів. При в / в введенні дія гепарину настає негайно, при в / м — через 45-60 хв. Спочатку вводять в / в 10 000 ОД гепарину, потім через кожні 4 год гепарин вводять в / м по 5000 ОД.
Лікування гепарином слід проводити під контролем часу згортання крові. Оптимальним вважається подовження згортання в 2.5 рази. За 3 дні до відміни гепарину призначають непрямі антикоагулянти — фенилин всередину (або синкумар, омефін тощо.) В дозі 0,03 г 2-3 рази на день, одночасно знижуючи добову дозу гепарину на 5000 ОД. Лікування анти «коагулянтами непрямої дії проводять під контролем протромбіновото індексу, який не слід знижувати більш ніж до 40%.
Для тромболітичної ефекту застосовують фибринолизин. Призначення фибринолизина показано в першу добу і навіть годинник від початку інфаркту. Фибрино лізин необхідно вводити одночасно з гепарином.
У комплексному лікуванні інфаркту мозку в останні роки використовують кошти, що резистентність мозкових структур до гіпоксії. Доцільність застосування антигіпоксантів визначається тим, що порушення обмінних процесів в клітинах мозкової паренхіми зазвичай передують за часом грубому ураження мозку в формі набряку і, крім того, є однією з провідних причин набряку.
Висловлено припущення , що ні набряк мозку, а саме метаболічні зрушення і енергетичний дефіцит, якщо вони виникають на великій території мозку або при швидко розвивається ішемії, є чинником, що визначає порушення свідомості та інші загальномозкові симптоми при ішемічному інсульті. У зв'язку з цим антигипоксическая терапія може вважатися більш перспективною, ніж лікування розвиненого набряку мозку. Доцільність призначення антігіпокоіческой терапії визначається і тим, що в умовах гостро настав дефіциту мозкового кровопостачання і дезорганізації метаболізму вигідніше тимчасово знизити енергетичні потреби мозку і тим самим в якійсь мірі підвищити його резистентність до гіпоксії.
Відповідно вважається виправданим призначення ліків, що володіють інгібуючим дією на енергетичний баланс. З цією метою застосовують антипіретичні препарати і реґіонарну гіпотермію, нові синтетичні засоби, які надають гальмівну дію на ферментативні процеси і метаболізм у мозку, а також речовини, що підвищують енергопродукцію в умовах гіпоксії. До таких речовин відносяться похідні метілфеназіна, деривати сечовини — гутімін і пірацетам (ноотропіл), які призначають по 5 мл в / в або по 1 мл 3 рази на день в / м. Ця група антигипоксантов робить позитивний вплив на процеси тканинного дихання, фосфорилювання і гліколізу. З позитивного боку зарекомендував себе фенобарбітал, чітко знижує споживання кисню мізкам і підвищує пережіваемость мозку шляхом зменшення метаболічних процесів і уповільнення накопичення внутрішньоклітинної рідини.
Серозні, або асептичні, менінгіти
Серозні, або асептичні, менінгіти — група захворювань, що характеризується серозним типом запалення м'яких оболонок мозку і відповідними запальними змінами в спинномозковій рідині — переважно лімфоцитарним плеоцитозом. Як і гнійні менінгіти, серозні менінгіти можуть бути первинними і вторинними. Вторинні серозні менінгіти виникають при найрізноманітніших інфекціях: полиомиелите, пневмонії, епідемічний паротит, тиф, бруцельоз, ревматизмі, різних інтоксикаціях і ін. Первинні серозні менінгіти викликаються вірусами. Найбільш відомі первинний гострий хореоменінгіт Армстронга і серозні менінгіти, викликані групою ентеровірусів Коксакі і ECHO.
Етіологія багатьох серозних менінгітів не встановлена.
Захворювання гострим серозним менінгітом можуть носити спорадичний характер, але іноді спостерігаються епідемічні спалахи, що вражають значні людські контингенти.
гострий лімфоцитарний хориоменингит (гострий серозний менінгіт Армстронга). Гострий лімфоцитарний менінгіт викликається вірусом, виділених в чистому вигляді Армстронгом і Ліллі в 1934 р Згодом було показано [Райвс, Худоба, 1936], що вірус, виділений з спинномозкової рідини хворих на серозний менінгіт, викликав лімфоцитарний запальний процес в оболонках і хореоідальние сплетеннях експериментальних тварин.
Захворювання передається домашніми мишами. Вірус виділяється з сечею, калом, носовим слизом цих тварин. Миші можуть заразити їм продукти харчування та предмети домашнього вжитку. В організм людини вірус потрапляє, найімовірніше, через дихальні шляхи. Захворювання може приймати характер невеликих епідемічних спалахів, які виникають переважно в зимово-весняний період. Хворіють люди різного віку, але частіше дорослі в 20-35 років.
Морфологія серозних менінгітів
У інфікованих експериментальних тварин виявляється інтенсивна лімфоцитарна інфільтрація м'яких оболонок епендими шлуночків і хореідальних сплетінь. Такі ж зміни виявлені в мозку хворих, які померли від цієї інфекції [Viets, Warren, 1937]. Вогнища запалення і некрозу виявляються в корі, стовбурі мозку і спинному мозку.
Клініка серозних менінгітів
Гострий серозний менінгіт зазвичай починається раптово, на тлі повного здоров'я. У деяких випадках захворювання передує досить тривалий продромальний період у вигляді загального нездужання, втоми, головного болю, катаральних явищ. Підвищується температура, виникають головний біль, іноді блювота. Нерідко хворих турбують болі в очних яблуках, відчуття тиску в них. Менінгеальні симптоми можуть бути помірними, але іноді є різко виражена ригідність м'язів потилиці, позитивний симптом Керніга, верхній і нижній симптоми Брудзинського. Загальна гіперестезія незначна або взагалі відсутня. Уже в перші дні захворювання з'являються ознаки ураження окремих черепних нервів, а також симптоми, що свідчать про ураження речовини мозку — патологічні стопного знаки, анизорефлексия, порушення координації. Приблизно у половини хворих виявляються застійні явища на очному дні: легкий набряк сосків, розмиття кордонів, розширення і звивистість вен.
Люмбальная пункція при серозний менінгіт проводиться як з діагностичною, так і з лікувальною метою. Після виведення невеликої кількості рідини помітно зменшуються або навіть зовсім припиняються головний біль і блювота. Спинномозкова рідина витікає під великим тиском. Вона безбарвна, прозора, іноді трохи опалесцйрует. Для хоріоменінгіту характерна виражена клітинно-білкова дисоціація: плеоцитоз досягає десятків або сотень клітин, переважно лімфоцитів, рівень білка залишається в межах норми або злегка підвищений. Вміст цукру і хлоридів нормальне або злегка знижений. Плеоцитоз в спинномозковій рідині підтримується тривалий час і знижується вже після зникнення клінічних симптомів.
Перебіг гострого серозного хоріоменінгіту в переважній кількості випадків сприятливий. Підвищена температура тримається 1-2 тижні, менінгеальні явища -2-4 тижнів, і потім стан нормалізується. Однак можливі випадки більш тяжкого перебігу, навіть з летальним результатом [Warkel et al., 1973]. Типовим для серозного менінгіту є нестійкість симптомів, їх оборотність протягом захворювання. Ускладнення у вигляді застійних сосків зорових нервів з подальшою атрофією зустрічаються рідко. Іноді захворювання приймає характер хронічного процесу — розвиваються спайки між потовщеними оболонками, утворюються кісти, розширюються порожнини шлуночків мозку, формується картина водянки головного мозку.
Діагноз серозних менінгітів
Діагностика гострого серозного менінгіту Армстронга не представляє особливих труднощів: наявність у хворого помірно вираженого менінгеального синдрому на тлі підвищеної температури, характерні зміни в спинномозковій рідині дозволяють правильно оцінити характер захворювання. Вкрай відповідальним є проведення диференціального діагнозу з туберкульозним менінгітом. У всіх сумнівних випадках показано специфічне лікування.
Профілактика серозних менінгітів
Знищення мишей в житлових приміщеннях. Дезінфекція виділень хворих.
Серозні менінгіти, викликані вірусами Коксакі і ECHO
Епідеміологія серозних менінгітів
Віруси Коксакі вперше були виділені в 1948 р в селищі Коксакі штату Нью-Йорк в США. Трохи пізніше, в 1951 р були виявлені віруси ECHO .
Надалі було запропоновано об'єднати віруси поліомієліту, віруси Коксакі і ECHO в рід ентеровірусів, що входять до складу сімейства пикорнавирусов. Крім трьох типів вірусу поліомієліту, відомі ще 23 типи вірусу Коксакі А, 6 типів вірусу Коксакі В, 31 тип вірусу ECHO. Кількість їх з кожним роком збільшується. Віруси Коксакі і ECHO широко поширені серед населення. У випорожненнях здорових людей вони виявляються в 3-5% випадків всіх досліджень.
З відомих в даний час ентеровірусів безумовно патогенними є 40 штамів. Вони можуть викликати велику кількість захворювань: міалгії, герпангіни, захворювання центральної нервової системи, що супроводжуються розвитком парезів і паралічів, що нагадують поліомієліт. Ці ж віруси можуть також вражати оболонки мозку, викликаючи гострий серозний менінгіт. Ентеровірусна інфекція має високу контагіозність і тому викликаються нею захворювання найчастіше виникають у вигляді епідемічних спалахів. Є певна сезонність в їх виникненні з максимумом в літньо-осінній період. Хворіють переважно діти. Висока контагіозність і масовість захворювань дозволяють припускати повітряно-крапельний спосіб передачі інфекції. Однак не можна повністю виключити можливість кишкового шляху її поширення.
У маленьких дітей серозні менінгіти частіше викликаються вірусами Коксакі групи В, з вірусів ECHO поразки оболонки мозку частіше відзначається при впливі типів 4, 6, 9.
Клініка серозних менінгітів
Серозний менінгіт, викликаний вірусами Коксакі, як правило, починається гостро, супроводжується різким підйомом температури, сильним головним болем, блювотою, менінгеальних симптомів. Нерідко відзначаються фарингіти, герпетичні висипання на губах і в області носа, герпангіна. У спинномозковій рідині виявляється підвищений цитоз, переважно лімфоцитарний, рівень білка залишається нормальним або злегка підвищеним. Висока температура тримається близько тижня, іноді вона знижується на 3-4-й день.
Відмінною рисою серозних менінгітів, викликаних групою ентеровірусів, є виникнення поліморфної висипки. Приблизно в 10% випадків на шкірі виникає розеольозний поліморфно-плямистий висип, що нагадує висип при кору або краснухи. Висип може зникнути вже через кілька годин після появи і тому не завжди фіксується лікарями. Зміни в крові не постійні, але можливий зсув лейкоцитарної формули вліво при нормальному або декілька збільшеному лейкоцитозі. У деяких хворих визначається підвищена ШОЕ.
На очному дні іноді відзначається розширення, звивистість і легкий набряк повік, але вираженої картини застійних сосків зорових нервів не буває [Дукер М. Б., 1975].
Перебіг ентеровірусних менінгітів сприятливе, захворювання закінчуються повним відновленням порушених функцій. Однак слід мати на увазі схильність їх до рецидивів, частота яких коливається від 10 до 40% випадків. Клінічно рецидив проявляється погіршенням загального стану, підвищенням температури, посиленням головного болю, іноді появою блювоти. Знову виявляються зміни в спинномозковій рідині. Рецидив можливий в різні терміни — від 1 тижня до 1 міс. Незважаючи на наявність рецидивів результат захворювання залишається сприятливим.
Діагноз серозних менінгітів
Розпізнавання менінгіту не представляє особливих труднощів. Гострий початок захворювання, головний біль, менінгеаль симптоми і, нарешті, зміна спинномозкової рідини свідчать про наявність серозного менінгіту. Значно важче встановити його етіологію. Основною властивістю менінгітів ентеровірусного походження є їх висока контагіозність і звідси масовість ураження значних колективів, особливо дитячих. Серозні менінгіти іншої етіології виявляються або спорадично, або вражають людей не в настільки масових кількостях. Менш достовірними є чисто клінічні ознаки захворювання. Для отримання достовірної діагностики потрібні ретельні вірусологічні дослідження, що включають серологічні дослідження з визначенням антитіл в парних сироватках крові.
Профілактика серозних менінгітів
Важливе значення має рання госпіталізація хворих, накладення карантину на осіб, які контактували з хворим, попередження скупчування дітей в закритих приміщеннях під час епідемічних спалахів, проведення протиепідемічних заходів, встановлених для кишкових інфекцій.
Синдром Млявого дитини
При синдромі «млявого дитини» м'язи при пальпації м'які, пасивні руху в суглобах надмірно вільні, характерна «поза жаби» з відведеними стегнами і ротировался назовні стопами .
Причиною, що викликає синдром «млявого дитини», більш ніж в 60% випадків є рання форма хвороби Верднига — Гофмана. У значній кількості випадків має місце доброякісна вроджена гіпотонія, а також немаліновая, міотубулярная або мітохондріальна міопатія. Нерідко синдром «млявого дитини» обумовлений атонической формою дитячого церебрального паралічу і важкою формою рахіту. Він може спостерігатися при хворобі Дауна, синдром Марфана, при травмі спинного мозку. Описані випадки різних метаболічних порушень, що супроводжуються різко вираженою гіпотонією, наприклад, патологія обміну амінокислот, галактоземия, генералізована форма глікогенозу. При деяких формах метаболічних порушень можливо раціональне лікування (корекція обміну за допомогою спеціальних дієт при фенілкетонурії, галактоземії), застосування біотину при порушенні обміну амінокислоти лейцину (Keeton, Mossa, 1976].
При атонической формі дитячого церебрального паралічу атонія виникає в результаті ураження не тільки великих півкуль, а й мозочка. У таких дітей є виражене порушення інтелекту і на відміну від спинального або м'язового рівня ураження вдається викликати сухожильні рефлекси. При спостереженні за хворими в динаміці у них з'являються ознаки гіпертонусу іекстрапірамідні гіперкінези.
Вроджена форма спінальної аміотрофії Верднига — Гофмана характеризується майже повною відсутністю спонтанних рухів, страждає рано дихальна мускулатура. Вроджена м'язова дистрофія супроводжується чітким підвищенням ферментів в сироватці крові, особливо креатинфосфокінази. Рідкісні варіанти вродженої міастенії характеризуються дифузійної м'язовою слабкістю без грубої гіпотонії, а також участю бульбарної і лицьової мускулатури. Особливо характерно сприятливий вплив антихолінестеразних препаратів, що і дає можливість уточнити діагноз. Вроджена доброякісна гіпотонія відрізняється від інших форм наявністю спонтанних рухів і сухожильних рефлексів і зазвичай відсутністю бульбарних розладів. ЕМГ і визначення активності ферментів в сироватці крові не виявляють відхилень від норми.
и Лікування і прогноз при синдромі «млявого дитини» залежать від конкретної нозологічної форми. Необхідний наполегливий пошук правильного діагнозу з використанням електрофізіологічних, тонких біохімічних і патоморфологічних методів.
синдром паркінсонізму
У 1817 р англійський лікар Джеймс Паркінсон описав захворювання, основним проявом якого була загальна скутість і тремтіння, і назвав його не зовсім вдалим терміном »« paralisis agitans »-« тремтливий параліч ». У 1877 р відомий французький невролог Шарко дав більш докладний опис клінічних симптомів захворювання і запропонував іншу назву — хвороба Паркінсона.
Епідеміологія синдрому паркінсонізму
Захворювання зустрічається серед населення всіх континентів земної кулі. Частота його, за даними різних авторів, коливається від 60 до 140 на 100 000 населення, різко збільшуючись з віком. За даними Курланд (1958), у віковій групі старше 60 років хворі становлять 1%, а в популяції старше 85 років — 2,6%. Початок захворювання найчастіше відноситься до віку 55-60 років. Чоловіки хворіють дещо частіше, ніж жінки.
Етіологія синдрому паркінсонізму
Клінічні прояви синдрому паркінсонізму можуть бути обумовлені найрізноманітнішими факторами. В період епідемії летаргічного енцефаліту в більшості випадків розвиток клінічної картини захворювання пов'язували з перенесеним раніше енцефалітом Економо. Припускають, що синдром паркінсонізму може бути викликаний і іншими інфекціями, в тому числі вірусом Коксакі типу В, вірусом японського енцефаліту, енцефаліту Сан-Луї і ін., Хоча подібні випадки зустрічаються значно рідше, ніж захворювання енцефалітом в період епідемії [Duovinson, Jahr, 1965]. Не виключається також певна роль повільних інфекцій в походженні цього захворювання. Але всі ці припущення вимагають подальших доказів.
Поєднання синдрому паркінсонізму з атеросклерозом послужило приводом вважати останній однією з можливих причин захворювання, проте спеціально проведені дослідження [Eadie, Sutherland, 1964] показали, що ступінь вираженості і поширеність ураження судин головного мозку при синдромі паркінсонізму не відрізняється від таких в контрольній групі хворих того ж віку і статі.
Безсумнівно, можливі випадки виникнення порушень мозкового кровообігу в області чорної субстанції і інших підкіркових вузлів. В результаті виникають симптоми, характерні для паркінсонізму, але подібні випадки зустрічаються щодо рідко. В даний час панівним є думка, що церебральний атеросклероз, як правило, не є причиною розвитку паркінсонізму. Ці два захворювання — паркінсонізм і атеросклероз — протікають паралельно і лише незначна частина хворих, у яких є вказівки на гостре виникнення проявів паркінсонізму, що супроводжуються зазначеними вище неврологічними симптомами, може бути віднесена до атеросклеротичного паркінсонізму.
Певну роль у виникненні акинетико -рігідного синдрому може грати спадково обумовлена неповноцінність підкіркових гангліїв. Ці випадки відносяться до хвороби Паркінсона.
Більш певної в етіологічному відношенні є група хворих з лікарським паркінсонізмом. Широке використання в медичній практиці препаратів фенотіазинового ряду, похідних раувольфії, метилдофа нерідко супроводжується виникненням синдрому паркінсонізму. Виникнення проявів синдрому паркінсонізму може бути обумовлено також багаторазовими травмами голови (у боксерів), інтоксикацією марганцем, окисом вуглецю, пухлиною мозку, субдуральної гематомою та багатьма іншими факторами. Виявлення зниження вмісту катехоламінів в базальних гангліях у цих хворих розкрило спільність патогенетичних механізмів акинетико-ригідного синдрому незалежно від етіологічних факторів.
Стало очевидним, що ті чи інші особливості синдрому, яким перш надавалася диференціальна діагностична значимість, визначаються не етіологічними факторами, а локалізацією процесу, його поширеністю і ступенем вираженості. Так, наприклад, окулогірні кризи, здавна розцінювалися як специфічний ознака синдрому паркінсонізму постенцефалітіческій генезу, частіше зустрічаються при передозуванні фенотіазинових препаратів.
Таким чином, проведення диференціального діагнозу по етіологічним даними є дуже важким, яскравим прикладом чого служить значний різнобій статистичних даних по етіологічним формам, що публікуються різними авторами. Найімовірніше припустити, що у всіх випадках синдрому паркінсонізму є генетично обумовлена неповноцінність ензимних систем, контролюючих обмін катехоламінів в мозку. Найрізноманітніші зовнішні чинники, в тому числі атеросклероз, інфекції, інтоксикації, повторні черепно-мозкові травми виявляють генетично обумовлену неповноцінність підкіркових структур. Підтвердженням цьому можуть служити спостереження за перебігом синдрому паркінсонізму лікарського генезу. У деяких хворих, які приймали великі дози фенотіазинових препаратів, який розвинувся синдром паркінсонізму зникає після відміни препаратів, тоді як у інших прояви захворювання, виникнувши на тлі прийому фенотіазинових препаратів, залишаються і після їх скасування.
У більшості випадків справжня причина виникнення захворювання залишається нез'ясованою. Єдиним критерієм його етіологічної природи в переважній більшості випадків можуть служити анамнестичні дані. Тільки в тих випадках, коли етіологічний фактор (гиперсомния, окорухові порушення, передозування медикаментів, інтоксикація марганцем) не викликає сумніву, можна говорити про ту чи іншу етіологічної формі захворювання.
Патологічна анатомія синдрому паркінсонізму
Передбачається, що основним субстратом, що піддаються ураженню при синдромі паркінсонізму є базальні ганглії. Ще в 1919 р Третьяков припустив, що причиною виникнення захворювання є ураження чорної субстанції. Це припущення потім було багаторазово підтверджено і уточнено іншими авторами. Показано, що при синдромі паркінсонізму є дегенеративні зміни в області компактної зони чорної субстанції і сірого плями, які полягають у зменшенні кількості клітин і розростанні гліальних елементів. Багато з НЕ загиблих ще нейронів чорної субстанції депігментованих, не містять мієліну. Особливо це наочно при синдромі паркінсонізму, розвиненому на одній стороні.
Специфічним для хвороби Паркінсона вважалося виявлення в гангліозних клітинах своєрідних скупчень сфероідних гліальних включень, які отримали найменування — тільця Леві. Зазвичай вони розташовуються в чорній субстанції, в сірому плямі покришки моста, дорсальних ядрах блукаючого нерва, симпатичних гангліях. При постенцефалітіческій синдромі паркінсонізму тільця Леві виявляються рідше. Для постенцефалітіческій паркінсонізму більш характерні нейрофібрилярних зміни гангліозних клітин.
Зміни, які виявляються в блідій кулі, менш, визначені. В одних випадках визначається атрофія цієї структури, в інших — виявлені явища демієлінізації, а в багатьох випадках взагалі не виявляється будь-яких змін. Отже, акинетико-ригідний синдром є не паллидарная, як передбачалося раніше, а нігральной синдромом. Слід підкреслити, що описувані гістопатологічні особливості мають вельми відносне діагностичне значення, так як вираженість виявляються морфологічних змін може досить широко варіювати.
Патогенез синдрому паркінсонізму
Основу всіх форм синдрому паркінсонізму складає різке зменшення концентрації допаміну в підкіркових вузлах і чорної субстанції. У нормі концентрація допаміну в цих утвореннях в сотні разів перевищує концентрацію допаміну в інших структурах мозку, що з переконливістю вказує на його важливу роль в діяльності екстрапірамідної системи. Руйнування чорної субстанції в експериментах на тваринах незмінно супроводжується зниженням концентрації допаміну в смугастому тілі. Пояснення цьому знаходять в тому, що допамін, що виробляється в чорній субстанції, по нігростріарной шляхах надходить в смугасте тіло. Руйнування чорної субстанції патологічним процесом при синдромі паркінсонізму різко знижує рівень допаміну і в смугастому тілі. Цим порушується нормальний стан рівноваги між допаміном і серотоніном з одного боку і ацетилхоліном і гістаміном — з іншого. Конкретні механізми реалізації біохімічних порушень в рухові розлади, характерні для синдрому паркінсонізму, остаточно не встановлені.
Передбачається, що основний дефект полягає в порушенні співвідношень між альфа- і гамма-системами з придушенням гамма і посиленням альфа-активності, що призводить до посилення тонічного рефлексу на розтягнення і виникненню ригідності і гіпокінезії.
Клініка синдрому паркінсонізму
Основними проявами паркінсонізму служать гіпокінезія, ригідність і тремор. Як правило, ці симптоми розвиваються поволі. Одним з перших проявів гіпокінезії може служити зміна почерку — зменшуються розміри і чіткість зображення букв. Поступово виникає відчуття скутості м'язів. У міру прогресування захворювання ригідність м'язів наростає, що супроводжується розвитком характерної пози з переважанням згиначів: голова зігнута і нахилена вперед, руки зігнуті в ліктьових суглобах і приведені до тулуба »спина зігнута, ноги злегка зігнуті в тазостегнових і колінних суглобах. Загальнаскутість хворого супроводжується уповільненням і бідністю рухів. Впадає в очі гипомимия. Особа стає маскоподібним, висловлюючи іноді застиглу гримасу здивування або печалі. Зміна одного емоційного прояву іншим відбувається значно повільніше, ніж в нормі, відсутні мигальні руху століття, мова стає монотонної і невиразною. Хворі можуть тривалий час підтримувати пози, неможливі для здорових людей, наприклад лежати, тримаючи голову над подушкою (так званий симптом повітряної подушки). Різко змінюється хода. Перші кроки робляться з великим зусиллям, а потім хворий рухається дрібними, семенящими кроками, темп яких поступово наростає, хворий як би «доганяє» свій власний центр тяжіння (пропульсия). Зупинитися йому так само важко, як і почати рух.
Одночасно може спостерігатися парадоксальна кінеза: хворий, з працею піднімається зі стільця, може легко вибігати по сходах, ходити, переступаючи через невеликі перешкоди, танцювати. Тимчасове «розгальмовування» може виникати під впливом ефектів радості або страху.
При дослідженні пасивних рухів у хворих відчувається посилений опір, виражене протягом усього часу виконання рухів, як при згинанні, так і при розгинанні (екстрапірамідна ригідність). Розгинання рук в ліктьових суглобах супроводжується відчуттям нерівномірності опору виробленому руху, що створює враження зіскакування зачіпляються між собою зубів шестерень — симптом «зубчастого колеса». Характерно положення пальців кисті — вони зігнуті в п'ястно-фалангових суглобах, I палець приведений до долоні. У більшості випадків в пальцях рук відзначаються мимовільні рухи — тремор. Найбільш типові ритмічні рухи I пальця кисті у напрямку до решти, що нагадує рахунок монет або скочування пігулок. Зазвичай тремор більш виражений в спокої і помітно зменшується під час виконання цілеспрямованих рухів. Розпочавшись з пальців рук, тремор у міру прогресування хвороби поширюється на інші м'язові групи, захоплюючи нижню щелепу, язик, губи, нижні кінцівки. Швидкість поширення і амплітуда тремтіння можуть широко варіювати. Емоційне напруження, підвищена увага зазвичай підсилюють вираженість тремору. Він зникає під час сну.
Характерною рисою тремору при паркінсонізмі є його частота — 4-8 коливань в секунду. Частота тремтіння в різних частинах тіла може бути різною, що свідчить про відсутність єдиного генератора паркинсонического ритму. Значне підвищення ригідності на пізніх стадіях захворювання може супроводжуватися зниженням амплітуди тремору або навіть його повним припиненням.
Досить часто у хворих виникають розлади акомодації, рідше — блефароспазм. Важко переносяться хворими окулогірні кризи — мимовільна тривала девіація очних яблук, що виникає частіше при погляді вгору. Як уже згадувалося, окулогірні кризи вважалися характерною ознакою паркінсонізму постенцефалітіческій генезу, проте останнім часом їх нерідко спостерігають і при лікарському паркінсонізмі. У більшості хворих відзначаються порушення вегетативних функцій: гіперсалівація, сальність особи, надлишкова гра вазомоторов, підвищення пітливості або, навпаки, сухість шкіри, розлад сечовипускання. Хворі часто скаржаться на запори, зумовлені атонією товстого кишечника. Щодо часто виникають вегетативні кризи, що супроводжуються різкою гіперемією особи, підвищеною пітливістю, тахікардією, емоційною напругою. Інтелект при паркінсонізмі зазвичай не страждає, однак досить часто відзначаються підвищена дратівливість, прихильність, плаксивість, депресія, що приводить іноді до суїцидальних дій.
Пірамідні симптоми характерні для синдрому паркінсонізму. Поява патологічних рефлексів в інших випадках пов'язують з впливом на спинний мозок остеофитов шийних хребців.
Соотншеніе вираженості основних симптомів захворювання у різних хворих може значно коливатися. У зв'язку з цим розрізняють акинетико-ригидную, ригидно-дрожательную і дрожательную його форми. Виявлення форми захворювання є досить суттєвим фактором при виборі методу лікування.
Діагноз синдрому паркінсонізму не представляє особливих труднощів і в переважній більшості випадків визначається при першому огляді. Однак можуть мати місце випадки, коли необхідно проводити диференційний діагноз з деякими подібними формами. Паркінсоніческій тремор слід відрізняти від посиленого фізіологічного тремору, що виникає у здорових людей в результаті емоційної напруги, у літніх людей, у хворих на алкоголізм, при тиреотоксикозі. Частота посиленого фізіологічного тремору зазвичай вище, ніж паркинсонического (10-12 Гц), тремор пальців не супроводжується приведенням і відведенням I пальця по відношенню до решти. Швидкість виконання інших рухів не знижена. Ці ж ознаки характеризують генетично обумовлений есенціальний тремор. Атрофічні процеси в мозочку, що розвиваються у деяких хворих з віком, можуть супроводжуватися виникненням интенционного тремтіння. На відміну від паркинсонического тремору интенционное тремтіння не виражено в спокої і посилюється при русі руки до певної мети, наприклад кінчика носа при виконанні пальценосовой проби.
Клінічна картина, що нагадує хворобу Паркінсона, може спостерігатися при атеросклеротичної деменції, що супроводжується загальною апатією і підвищенням м'язового тонусу.
Отдифференцировать цю групу хворих допомагає виявлення у них підвищених сухожильних рефлексів, патологічних рефлексів, псевдобульбарного симптомів. При проведенні диференціального діагнозу слід враховувати ряд клінічних синдромів, близьких за своєю симптоматиці до паркінсонізму, але вимагають інших терапевтичних підходів і відрізняються в прогностичному відношенні. Так само як синдром Шая — Дрейджера, що характеризується поєднанням симптомів паркінсонізму з нетриманням сечі, імпотенцією, ангідрозом, ортостатичної гіпотензій, до яких в ході розвитку захворювання можуть приєднуватися мозжечковая дискінезія, м'язова атрофія і фасцікуляціі. Виникнення вегетативних порушень може передувати розвитку симптомів паркінсонізму. Захворювання розвивається в середньому віці, зазвичай в більш молодому, ніж при звичайному паркінсонізмі. Морфологічні дослідження виявляють зміни не тільки в чорній субстанції, але ознаки олівопонтоцеребеллярная атрофії, а також порушення в бічних і передніх рогах спинного мозку. Для лікування захворювання застосовують мінералокортикоїди, а також 1-дофа.
Гіпокінезія і ригідність можуть бути проявами прогресуючого над'ядерний параліч, описаного Steel і співавт. в 1964 р Тремор при цьому захворюванні зустрічається рідко.
Типовими є своєрідні окорухові розлади: спочатку виникає обмеження рухів очей у вертикальному напрямку, потім розвивається офтальмоплегия, при цьому повною мірою зберігаються руху очей, пов'язані з фіксацією поглядом предмета, при пасивному переміщенні голови. Описані окорухові порушення можуть поєднуватися з дистонією шийних м'язів, пірамідними симптомами, помірною деменцією. Гіпокінезія і ригідність можуть спостерігатися при хворобі Крейтцфельда — Якобі поряд з деменцією, симптомами ураження пірамідних шляхів, міоклонію і ознаками ураження периферичного мотонейрона. Деякими паркинсоническими симптомами, найчастіше гипокинезией і ригідністю, можуть супроводжуватися дегенеративні захворювання типу олівопонтоцеребеллярная дистрофії, що характеризуються зазвичай прогресуючими явищами мозочкової атаксії. На розтині в таких випадках поряд з типовою для цього захворювання атрофією кори мозочка, олив і ядер мозку, виявляють ураження чорної субстанції, стриатума.
Паркинсонизм — захворювання хронічне, повільно поточне. Воно, як правило, не веде до летального результату, але летальність серед цих хворих утричі перевищує таку в загальній популяції людей цього ж віку. Хворі вмирають від приєдналися інтеркурентних захворювань (пневмонія, пролежні).
Лікування синдрому паркінсонізму
Ще з часів Шарко для лікування синдрому паркінсонізму застосовують препарати беладони. Вибір їх був в значній мірі випадковий, але в останні роки він отримав теоретичне обгрунтування — придушення холинергических механізмів супроводжується деяким вирівнюванням порушеної рівноваги ацетилхолін — допамін. В даний час частіше вдаються ні до природним, а синтетичним антихолинергическим препаратів (циклодол, рідінол, мебедрол, дінезін, амедін). Велика кількість цих ліків свідчить про те, що жодне з них не є достатньо ефективним. Вибір препарату зазвичай визначається індивідуальною реакцією хворого. Підбір дози починають з невеликих кількостей препарату, потім її поступово збільшують до отримання ефекту або появи побічних явищ, найчастіше відчуттів затуманення зору і сухості в роті. Виникнення цих симптомів служить сигналом для зниження добової дози препарату.
Застосування антихолінергічних препаратів може супроводжуватися і більш серйозними ускладненнями — галюцинаціями, особливо зоровими, психічними порушеннями (атропіновий психоз), почуттям тривоги, затримкою сечі, виникненням або загостренням глаукоми, часто вимагають відміни препарату. Слід призначати препарати, які надають центральне антихолінергічну дію і мінімально виражені периферичні ефекти (рідінол і ін.). Антихолінергічні препарати покращують стан хворих, зменшують ригідність, тремор і акінезія. Раптова відміна антихолінергічних засобів може викликати значне посилення проявів захворювання. Оскільки певну роль в розвитку паркінсонізму може грати не тільки допамін, а й інші медіатори, зокрема гістамін, для лікування паркінсонізму показані також антигістамінні препарати (димедрол, супрастин та ін.), Особливо при наявності вираженого тремору.
Істотне значення надається також групі препаратів-інгібіторів моноаміноксидази (МАО), ферменту, який бере участь у перетворенні допаміну в норадреналін. Ці препарати, зокрема ниаламид, мають антидепресивну дію і особливо показані при наявності депресивних станів. При всіх початкових формах захворювання слід починати лікування із застосування антихолінергічних препаратів або їх комбінацій з антигістамінними засобами.
З'ясування ролі допаминергических систем в патогенезі паркінсонізму призвело до впровадження в практику значно ефективніших препаратів, зокрема 1-дофа. На відміну від допаміну 1 -дофа проникає через гематоенцефалічний бар'єр. В організмі людини він під впливом ферменту ДОФА-декарбоксилази перетворюється в допамін і компенсує його недолік в смугастому тілі. Протипоказаннями для застосування 1-дофа є виражені порушення в діяльності серцево-судинної системи з явищами стійкої декомпенсації та порушеннями серцевого ритму, що кровоточать виразки шлунка і дванадцятипалої кишки, гепатити, цирози печінки, нефрити, психічні захворювання, глаукома.
Застосування препарату починається з малих доз (0,125г), які поступово нарощуються. Прийом ліки проводиться за схемою, що передбачає багаторазовий його прийом — 5-6 разів на добу. Так як препарат може надавати подразнює слизисту шлунку і шлунково-кишкового тракту, то прийом його рекомендується проводити під час прийняття їжі. Найбільш виражений ефект при лікуванні 1 -дофа відзначається відносно гіпокінезії зменшується загальна скутість, підвищується рухливість хворих. Помітно зменшується також ригідність. Менш ефективним є застосування 1-дофа при треморе, тому лікування 1 -дофа більш показано при акинетико-ригидной і ригидной формах захворювання і менше — при дрожательной або тремтливий-ригидной його формах.
У всіх випадках більш ефективним є комбіноване застосування антихолінергічних препаратів і 1 -дофа, але особливо воно показане при тремтливий-ригидной і дрожательной формах в початковому періоді. Не слід поспішати з нарощуванням дози 1 -дофа, що дозволяє позбутися від багатьох сторонніх ефектів, які можуть супроводжувати прийом препарату.
Щодо частими ускладненнями, що виникають при лікуванні 1 -дофа є нудота, блювота, анорексія. Ці порушення найчастіше відзначаються в початковій стадії лікування, в період підвищення дози препарату. Їх виникнення відзначається приблизно у половини хворих. Для їх ліквідації або зниження, як уже згадувалося, препарат приймають під час їжі, дозу його підвищують повільно, запивають лужними мінеральними водами. З інших ускладнень раннього періоду слід вказати на постуральна гіпотензія, яка може виникати без будь-яких провісників. Іноді розвивається аритмія. Щоб уникнути шкідливих наслідків хворим рекомендується полежати деякий час після прийому препарату. В даний час є багато комбінованих препаратів, що викликають меншу кількість ускладнень, зокрема сінемет, мадопар, НАКом. Застосування комбінованих препаратів різко скоротило кількість 1 -дофа, необхідне для отримання клінічного ефекту. Застосування Сінемет супроводжується зменшенням дози в 10 разів (25 мг замість 250 мг), мадопара — в 4 рази. На жаль, комбіноване лікування 1 -дофа і інгібітором ДОФА-декарбоксилази в меншій мірі вплинуло на розвиток інших ускладнень, — швидких гіперкінезів і психічних порушень, але вони виникають в більш пізні терміни, ніж при прийомі 1 -дофа.
Психічні порушення у вигляді агресивності, загального збудження виникають приблизно в XU випадків. У деяких хворих розвивається депресія аж до суїцидальних спроб. Іноді виникають психози, зазвичай паранойяльного характеру. Можливе підвищення лібідо у осіб обох статей.
Найбільш частим ускладненням, що виникає при прийомі 1 -дофа, є розвиток швидких гіперкінезів. Вони зазвичай починаються в оральної мускулатури, потім поширюються на м'язи обличчя, висловлюючись у вигляді гримасничанья ,, жувальних рухів, обертальних рухів мови. Оральні дискінезії можуть надалі супроводжуватися згинання та розгинання кінцівок, дистонічну явищами у вигляді спастичного кривошиї, роторних спазмів тулуба та ін. Дискинезии зазвичай виникають при прийомі великих доз препарату, але у деяких хворих вони виникають і при малих дозах. Як правило, поява швидких гіперкінезів свідчить про передозування препарату. Для їх ліквідації дозу 1 -дофа слід знизити, ввести розчин вітаміну В6 в / м, призначити допегит. Подальше підвищення дозування 1 -дофа потрібно виробляти в більш повільному темпі. Слід підкреслити, що рання поява оральних гіперкінезів зазвичай є ознакою високої ефективності лікування 1 -дофа v даного хворого.
Терапію 1 -дофа і його похідними краще поєднувати із застосуванням холінолітиків, антигістамінних (димедрол ,, супрастин), судинорозширювальних (цинаризин — стугерон, дибазол) і антисклеротичну препаратів (місклерон, продектин). У лікуванні синдрому паркінсонізму широке застосування отримали амантадин і його аналоги (вірегіт, мидантан). Спочатку він застосовувався як противірусний засіб, але незабаром чисто емпірично був відзначений його антипаркінсонічний ефект. Дія амандатіна проявляється швидше, ніж 1 -дофа, зазвичай між другою і четвертою тижнями після початку лікування, однак ефективність його нижче. Більший вплив амантадин надає на гипокинезию і ригідність і менш виражене на тремор. Побічні його явища схожі з ускладненнями, що виникають при призначенні 1 -дофа, але виражені в меншому ступені.
Комбінація амантадина і 1 -дофа надає синергізм і широко застосовується в практиці. Механізм дії амантадину до кінця не з'ясований, передбачається, що він полегшує синтез допаміну. Амантадин можна призначати в чистому вигляді або в комбінації з антихолінергічними препаратами хворим, які погано переносять 1 -дофа або його похідні (сінемет, НАКом, мадопар). У самий останній час для лікування синдрому паркінсонізму запропонований бромкриптин, активатор допаминергических рецепторів.
На ранніх етапах лікування ефект від застосування 1-дофа спостерігається приблизно у 2/3 хворих, переважно з ригидной або ригидно-дрожательной формою захворювання, проте з плином часу його позитивну дію зменшується. Найбільш неприємним ускладненням в пізньому періоді лікування 1 -дофа є розвиток так званого ефекту включення-виключення.
Клінічна картина цього феномена виражається в несподіваному виникненні різко виражених гіперкінезів, порушення ходи, різкою гіпотонії, які виникають незабаром після прийому звичайної дози ліків. Тривалість цих порушень може коливатися від декількох хвилин до декількох годин і також зненацька змінюватися повним завмиранням, вираженим проявом акинезії, скутості. Такі різкі зміни стану можуть повторюватися по кілька разів на день. Вони дуже важко переносяться хворими. Як правило, виникнення цього феномена відзначається у хворих, у яких був хороший ефект від застосування 1-дофа. Для боротьби з подібними ускладненнями слід вдатися до більш частого прийому 1-дофа без зміни або зі зниженням загальної добової дози препарату. Лікування комбінованими препаратами відтягує виникнення цього важкого ускладнення, але повністю від нього не позбавляє.
Хірургічні методи лікування з введенням в практику лікування 1 -дофа втратили -Свої значення і застосовуються тими хворими, які виявилися резистентними до дії 3 -дофа. Зазвичай це хворі з дрожательной або ригидно-дрожательной формою, особливо при односторонньому її прояві. Руйнації в даний час піддаються вентролатеральное ядро таламуса і поля Фореля. Цим досягається найбільш сприятливий ефект, що виражається в моментальному зникнення тремору і ригідності вже на операційному столі. Віддалені результати хірургічного лікування синдрому паркінсонізму задовільні. На прикладі цього важкого захворювання особливо яскраво видно досягнуті в даний час успіхи патогенетичного лікування багатьох дегенеративних захворювань, що вважалися раніше погано піддаються лікуванню або взагалі невиліковними.
Новини по темі:
 Не так давно ми вже говорили про новий метод діагностики хвороби Альцгеймера, розробленому студентом. Сьогодні ж американські вчені запропонували світу іншу систему постановки діагнозу з підвищеним рівнем точності одержуваного результату. Простота діагностики здатна здивувати і навіть вразити: пацієнтові досить зробити один малюнок
Не так давно ми вже говорили про новий метод діагностики хвороби Альцгеймера, розробленому студентом. Сьогодні ж американські вчені запропонували світу іншу систему постановки діагнозу з підвищеним рівнем точності одержуваного результату. Простота діагностики здатна здивувати і навіть вразити: пацієнтові досить зробити один малюнок  Змусити людину жити довше — ось мета даного проекту. Реалізацією такого зайнялася компанія Calico, заснована відомим у світі брендом Google два роки тому. Представники такої вивчать геном мільйонів людей для того, щоб з'ясувати причини і можливості впливу на довголіття. Нещодавно Calico ініціювала перше за час свого
Змусити людину жити довше — ось мета даного проекту. Реалізацією такого зайнялася компанія Calico, заснована відомим у світі брендом Google два роки тому. Представники такої вивчать геном мільйонів людей для того, щоб з'ясувати причини і можливості впливу на довголіття. Нещодавно Calico ініціювала перше за час свого  Американські вчені висунули припущення (і, зрозуміло, підкріпили таке відповідними дослідженнями ) про те, що стан зубів людини може дозволити медикам зробити висновок про ймовірність подальшого придбання якого-небудь захворювання мозку. Маниша Арора, співробітник школи медицини Ікан (Маунт Снай, Нью-Йорк, США)
Американські вчені висунули припущення (і, зрозуміло, підкріпили таке відповідними дослідженнями ) про те, що стан зубів людини може дозволити медикам зробити висновок про ймовірність подальшого придбання якого-небудь захворювання мозку. Маниша Арора, співробітник школи медицини Ікан (Маунт Снай, Нью-Йорк, США)  До таких висновків вчені прийшли внаслідок дослідження людей, які приймають два види лікарських засобів, що застосовуються при лікуванні неврологічних і психічних захворювань. Виявилося, що в якості побічної дії, препарати можуть впливати на характер пацієнта. Дослідження проводилися на базі Університетського
До таких висновків вчені прийшли внаслідок дослідження людей, які приймають два види лікарських засобів, що застосовуються при лікуванні неврологічних і психічних захворювань. Виявилося, що в якості побічної дії, препарати можуть впливати на характер пацієнта. Дослідження проводилися на базі Університетського
Синдром зап'ястного каналу
Нічні парестезії рук (статичні парестетіческая брахиалгии) в одних випадках обумовлені даними синдромом, в інших — синдромами передній сходовому або малої грудної м'язи, а в ряді випадків — порушеннями загального характеру (ендокринні та інші впливи на вазомоторні системи рук) .
Синдром Лоренса-Муна-Бідла
Клініка
Найбільш типовими симптомами, що формують цей синдром, є пігментний ретиніт, ожиріння, полідактилія, розумова відсталість, гипогенитализм. Порушення зору з'являються в шкільному віці і поступово прогресують. На периферії сітківки відзначаються скупчення пігменту, що нагадують «сіль з перцем». Ці зміни обумовлені дегенеративним процесом в сітківці ока і в пігментному епітелії сітківки. До 30-35 років більшість хворих повністю втрачають зір.
Підвищена маса тіла відзначається вже в момент народження, але потім помітно збільшується в дитячому віці і пізніше. Апетит може залишатися нормальним. Відкладення жиру відбувається на тулуб і проксимальних відділах кінцівок, дистальні їх відділи залишаються звичайними. Третім за частотою симптомом є полідактилія або інші аномалії в будові скелета. Полідактилія (найчастіше шестипалість на руках) виражена симетрично, але в рідкісних випадках можливо її прояв на одній стороні. Не завжди зайвий палець видно, в деяких випадках його рудименти виявляються при рентгенологічному дослідженні. Можливі й інші аномалії, наприклад плоскостопість, genu valgum. Зустрічаються аномалії в будові черепа (брахицефалия, акроцефалія і ін.), Аномалії хребта (кіфоз, сколіоз).
Відставання в інтелектуальному розвитку зустрічається часто, але не є обов'язковим симптомом захворювання. Разом з тим зниження інтелекту можливо до рівня ідіотії.
гипогенитализмом частіше зустрічається у чоловіків, ніж у жінок. Має місце крипторхізм, зниження потенції, лібідо, порушується процес сперматогенезу. У той же час в літературі є опис випадків, коли жінки, які страждають на це захворювання, виходили заміж і мали дітей.
Захворювання в більшості випадків спадково обумовлене. Передача здійснюється за аутосомно-рецесивним типом.
Лікування
Специфічного лікування не існує. Поліпшення стану хворих можна отримати при застосуванні замісної гормональної терапії.