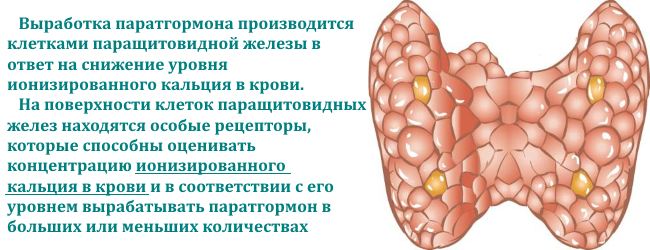
Кальцій — один із самих основних мікроелементів людського організму, який відповідає за стан кісток, нервову збудливість і скоротливість м'язів.
Кальцій — це
основний позитивно заряджений іон, який перебуває поза клітиною. Присутній у всіх клітинах. Кальцію в тілі досить багато — 2% від маси тіла.
Концентрація кальцію в самій клітці в кілька разів нижче, ніж у позаклітинному просторі. У той же час, різке тимчасове підвищення колічеcтва іонів кальцію всередині клітини — основа безлічі фізіологічних процесів, починаючи від порушення м'язової і нервової клітин, закінчуючи вивільненням медіаторів і гормонів.
Розподіл кальцію в тілі
- 99% кальцію покладені в кістковій тканині і в зубах — даний кальцію розчиняється, метаболічно неактивний, це депо з якого буде братися кальцій в випадку його потреби
- 1% кальцію циркулює в , представлений 3 формами:
- неіонізовану кальцій (45%) — пов'язаний з білками(Переважно альбумінами), які роблять його недоступним для обміну
- пов'язаний з органічними речовинами (5%) , переважно цитратами
- іонізований кальцій або вільний (50%) — не пов'язаний з іншими молекулами, це чистий Ca 2 + , найбільш важливий і потрібний лікаря показник кальцієвого обміну
Функції кальцію
- фактор (фактор IV коагуляционного каскаду)
- бере участь в утворенні кінінів (білків запалення)
- регулює синтез і виділення деяких ферментів і гормонів ()
- внутрішньоклітинний передавач сигналів (вторинний месенджер)
- регулятор збудливості тканин
- в скелетних м'язах активує , завдяки чому відбувається скорочення
- в гладких м'язах кальцій зв'язується з кальмодулином, що також веде до повільного скорочення
- підтримує потенціал дії клітини, необхідний для передачі нервового імпульсу, збудження, руху клітини, процесу розподілу, підтримки структуральної цілісності
Метаболізм кальцію
У день доросла людина повинна «з'їдати» близько 1 грама кальцію . Активне всмоктування Ca 2 + відбувається в 12-палої і порожній кишці, а пасивне — в товстому кишечнику. Тіло споживає від 25 до 40% надходження мікроелемента. Лужне середовище значно покращує процес абсорбції.
Нирки здатні профільтрувати виключно вільний іонізований кальцій — Ca 2 + . Але, при подальшому проходженні первинної сечі по канальцях, він назад реабсорбируется під впливом , кальцитоніну і кальцитріолу (вітаміну D).

Гормони-регулятори обміну кальцію
- паратгормон — гормон прищитовидних залози, підвищує рівень кальцію в крові діючи на кістки (результат залежить від інтервалів секреції — пульсірущая — підвищення Ca 2 + , постійна — зниження Ca 2 + ), нирки (підсилює зворотне всмоктування Ca 2 + ) і кишечник (активує абсорбцію Ca 2 + )
- кальцитонін — гормон С-клітинщитовидної залози — його дія на метаболізм кальцію протилежно паратгормону: пригнічує кишкову і ниркову абсорбцію кальцію, стимулює утворення кістки і укладає в неї кальцій, знижуючи тим самим концентрацію в крові
- вітамін D — підвищує Ca 2 + в крові, шляхом активації процесу всмоктування в кишечнику
Аналіз крові на кальцій призначається
- оцінка обміну мікроелементів,
- рання діагностика захворювань прищитовидних залоз, нирок, метаболічних розладів
- всім хворим на , у відділенні інтенсивної терапії, які перебувають на , що страждають хронічними захворюваннями
- при виявленні підвищеного рівня фосфору в крові або сечі
- при наявності симптомів підвищеного або зниженого рівня кальцію в крові (читай нижче)
- підозра на патологію прищитовидних залоз, щитовидної залози
- захворюванняхтравної системи, нирок, кісток, нервової системи
- в контролі успішності лікування препаратами кальцію та вітаміну D
- зміни на ЕКГ
- при лікуванні
- у (в деяких випадках)
Норма кальцію в крові, ммоль / л
- новонароджені 0-1 тиждень — 1,8-2,8
- діти до 2 років — 2, 0-2,9
- діти від 2років і дорослі (чоловіки і жінки) — 2.0-2,75
Норма кальцію в сечі, ммоль / 24 години
- діти до 28 днів 0,0-1,5
- діти від 4 тижнів до 1 року — 0,1-2,5
- діти від 1 до 15 років — 2,0-4,0
- від 1 року, включаючи дорослих (чоловіки , жінки) — 2,4 — 7,2
Пам'ятайте, що у кожної лабораторії, а точніше у лабораторного обладнання іреактивів є «свої» норми. У бланку лабораторного дослідження вони йдуть в графі — референсні значення або норма.
Аналіз на кальцій проводять разом з наступними дослідженнями
- — , , , ,
- — , ,
- вітамін D
- і
- паратгормон
- — ТТГ, вільний Т4
- і в сечі — , , , ,
6 фактів про кальцій
- в тілі людини вагою 70 кг міститься 1,4 кг кальцію
- кальцій міститься в молоці, твердих і м'яких сирах, яйцях і«Жорсткої воді»
- визначення кількості кальцію в крові не дає можливості судити про його запаси в кістках
- алкалоз або лужна реакція крові призводять до підвищеного зв'язування кальцію з білками крові, що знижує рівень вільного іона Ca 2 + , в той же час загальна концентрація кальцію залишається в межах норми, тому при прискореному диханні і спостерігаються судоми (тетанія)
- з метаболізмом кальцію тісно пов'язаний обмін фосфору — внутрішньовенне введення фосфатів веде до утворення кальцію фосфату, який відкладається в кістках, арівень кальцію в крові — знижується
- гипофосфатемия призводить до гіперкальціємії шляхом вимивання кальцію з кісток
Фактори, що впливають на результат аналізу кальцію
- знижують рівень вітаміну D і, відповідно, кальцію, протисудомні препарати
- біфосфонати, кальцитонін, фосфати, кетоконазол, протипухлинні препарати (цисплатину, доксирубіцином) призводять до посиленого виведення кальцію нирками і зниження рівня вкрові
- , , період активного росту у дітей — концентрація кальцію знижується через перерозподіл в тканини
- препарати, що підвищують рівень кальцію в крові: вітамін D, тіазидні діуретики, літій, естрогени, андрогени, вітамін А
Причини зниженого рівня кальцію в крові
Знижений рівень кальцію (гіпокальціємія) спостерігається при таких захворюваннях:
1. Знижена функція прищитовидних залоз
- після операцій на щитовидній залозі — кровопостачання прищитовидних залоз частково йде від судин щитовидної залози, в результаті пошкодження при втручаннях на щитовидній залозі, функція прищитовидних залоз повністю відновлюється через 3-6 місяців, в окремих випадках віддаляються 1-2-3-4 прищитовидних залози помилково, що вимагає довічного прийому кальцію
- опромінення органів шиї — при пухлинних захворюваннях щитовидної залози, слинних залоз,
- при цервікальному синдромі — знижена функція прищитовидних залоз при захворюваннях шийного відділу хребта
- ідіопатичний і сімейний гипопаратиреоз
- синдрому Мартіна-Олбрайта або псевдогіпопаратіреоідний синдром (гіпокальціємія, гіперфосфатемія, низький зріст, надлишковий вага, ахондроплазия, розумова відсталість)
- інфільрація прищитовидних залоз при , , , метастазах
- аутоімунні захворювання прищитовидних залоз — імунна система спрямована проти власних тканин
- аплазія і

2. Дефіцит вітаміну D
- зменшенні споживання продуктів, що містять вітамін D — екстремальні дієти, анорексія
- порушення всмоктування вітаміну D в кишечнику ()
- після операцій шлунка і тонкого кишечника — зменшується площа всмоктування
- захворювання нирок і печінки, де відбуваються основні етапи обміну вітаміну D — ,
- при недостатньому перебування на (рідко)
- нечутливість організму до вітаміну D —
3. інші причини
- мала кількість кальцію в їжі
- ізольований дефіцит всмоктування кальцію в кишечнику — при великій кількості щавлевої кислоти в раціоні (ревінь, шпинат, полуниця)
- гостре запалення — з панкреонекроз — жирні кислоти, утворюють з кальцієм нерозчинні мила
- деякі види метастазів в кісткову тканину
- — перебудова структури печінки зі зниженням функціонально активної тканини
- нефротичний синдром при захворюваннях нирок, денна втрата білків з сечею перевищує 3,5 г / л (, фокальний сегментарний гломерулосклероз, , )
- виражений дефіцитмагнію
- хвороба і синдром Іценко-Кушинга
- внутрішньовенне введення фосфатів
- повторні переливання крові, в якій антикоагулянтом є цитрат (пов'язує кальцій)
- гостре пошкодження м'язової тканини — синдром тривалого здавлення, травми
- хронічні уповільнені захворювання — , ,
- і сепсис
Знижений рівень кальцію в сечі називається гіпокальціурія .
Найчастіші причини зниження концентрації кальцію в крові у дітей
- низька маса тіла при народженні
- народжених жінками, що страждають на цукровий діабет, з передеклампсія, патологією прищитовидних залоз — низький рівень кальцію в крові дитини є результатом захворювань у матері
- вітамін D-резистентнийрахіт
- тимчасово знижена функція прищитовидних залоз у новонароджених (рідко)
- при низькому рівні білка в крові, важкої ниркової недостатності, порушення всмоктування в кишечнику, харчуванні коров'ячим молоком
- у дітей, що приймають протисудомні препарати (при )
Симптоми зниженого рівня кальцію в крові
Симптоми гипокальциемии можуть бути самимирізноманітними, оскільки для утримання його рівня в крові запускається багато адаптаційних процесів.
- тетания — судомні скорочення м'язів в результаті підвищеної збудливості центральної і периферичної нервової системи, проявляється генералізованими судомами, порушенням мови , спазмом голосових зв'язок
- порушення процесу мислення
- міопатія — хворобливість м'язів, швидка стомлюваність, слабкість
- паркінсонізм, хореоатетоз
- розм'якшення кісток
- підвищена кровоточивість
- різна висипка, псоріатичні прояви, ламкість волосся, алопеція
- катаракта, неврит зорового нерва, набряк сосочка зорового нерва
- низький тиск крові, знижена провідність і скоротність серця
Симптоми гипокальциемии іноді маскує, а іноді погіршує супутня гіпомагнезіемія (низький рівень магнію в крові).
Причини підвищеного рівня кальцію
Гиперкальциемия — підвищення рівня кальцію в крові, виявляють переважно при патології прищитовидних залоз і пухлинних захворюваннях.
1. п овишенная функція прищитовидних залоз
- аденома прищитовидних залоз або їх гіперплазія — первинний гіперпаратиреоз
- болю в кістках і спонтанні переломи
- , нефокальціноз, порушення функції нирок з зниженням фільтраційної здатності, хронічна ниркова недостатність
- , гострий панкреатит, нудота, блювота,
- , аритмії, зупинка серця
- порушення психіки — м'язова слабкість, втома, депресія
- специфічні ураження ясен
2. пухлинні захворювання
- метастази в кістки з руйнуванням кісткової тканини при , , ,
- пухлини, що виробляють паратгормон-подібний пептид — пухлини грудей, легенів, нирок, сечового міхура, яєчників
- пухлини, що синтезують активні метаболіти вітаміну D —
3. підвищення рівня гормонів щитовидної залози — ,
4. гранулематозні захворювання — ,
5. інші захворювання
- тривала обездвиженность (після операцій, у паралізованих пацієнтів)
- або хронічна ниркова недостатність
- повне парентеральне харчування
- захворювання, що супроводжуються розпадом тканин — гангрена, , ,
- синдром Бурнетт (молочно-лужний синдром) — при надмірному споживанні молока, препаратів кальцію і ліків, нейтралізує шлунковий сік
- хвороба Аддісона -недостатність кори надниркових залоз
- — пухлина, що виробляє адреналін, норадреналін або дофамін
- пухлина, що продукує вазоактивний інтестинального пептид (ВІП)
- сімейна спадкова гіпоальціуріческая гіперкацльціемія
- гіпофосфатазія — вроджене спадкове захворювання зі зниженою активністю лужної фосфатази
- тривалий дихальний алкалоз
- хронічна ідіопатична гіперкальціємія у грудних дітей — причина не встановлена
Симптоми підвищеного рівня кальцію
- нудота, блювота, металевий присмак у роті, виразкова хвороба шлунка і 12-палої кишки, хронічні запори, панкреатит
- поліурія, полідипсія, ніктурія — людина багато п'є рідини , одночасно збільшено її виведення з сечею, підвищується кількість нічних відвідувань туалету
- головні болі, слабкість, хворобливість м'язів
- підвищенийартеріальний тиск, аритмії, вкорочення інтервалу QT, зупинка серця в систолі (при кальціємії більше 4 ммоль / л)
- блідість, кахектичних
- зниження кісткової маси
Магній в крові і сечі аналіз, норми і функції
Магній — один із самих основних мікроелементів людського організму, який відповідає за психічну рівновагу і відчуття спокою.
Магній — це
другий за значимістю (після кальцію) позитивно заряджений іон, який перебуває всередині клітини. Присутній у всіх клітинах.
Магній — ествественно антагоніст кальцію. Обидва іона стабілізують клітинну мембрану. Недолік обох веде до підвищення збудливості клітки і появи з боку м'язів і психічної дратівливості з боку нервової системи. Тому достатню кількість магнію необхідно для гарного настрою.
Розподіл магнію
- 50-60% постійно передається на зберігання до кістках, швидкість мобілізації — тижні
- 20-30% в м'язовій тканині — звідки його можна «вилучити» при потребі за кілька днів
- 10-19% магнію знаходиться в органах і тканинах, серед них печінка і селезінка — найшвидші «обмінники» іона — за кілька годин
- 1,3% розташовані внеклеточно, 0,3% в плазмі крові , 0,5% в — активне депо магнію
Якщо прийняти 0,3% магнію плазми крові за 100%,то:
- 30% пов'язані з білками крові (альбуміном)
- 5% в комплексах з іншими іонами
- 65% у вільному іонізованої формі — вимірюють при лабораторному дослідженні
Обмін магнію
в організм щодня надходить 200-300 мг магнію, з них 30-50% всмоктується в тонкому кишечнику, а виводиться нирками 100 мг / добу.
На мембрані клітин слизової оболонки кишечника і дистального канальця нирки знаходиться специфічний іонний магнієвий канал, ключовий регулятор обміну магнію в тілі — TRPM 6 (transient receptor potential melastin 6) .
Функції магнію
- активує більше 300 ферментів, впливаючи на метаболізм білків, жирів, вуглеводів і нуклеїнових кислоти
- життєво необхідний для утворення енергії, м'язових скорочень, транспорту інших іонів через мембрану, роботи нервових клітин і волокон, міцності кісток
- реалізує дію інсуліну в периферичних тканинах, визначає активність обміну і
- стабілізує великі молекули
Регулятори обміну магнію
Єдиного регулятора обміну магнію немає. На його концентрацію впливають:
- кальцій
- фосфор
- вітамін D
- селен
- йод
- кадмій
Аналіз крові на магній призначається
- оцінка обміну мікроелементів,
- всім хворим на , у відділенні інтенсивної терапії, які перебувають на , що страждають хронічними захворюваннями
- при виявленніпідвищеного рівня кальцію, фосфору або калію в крові або сечі
- при наявності симптомів підвищеного або зниженого рівня магнію (читайте нижче)
- захворюваннях травної системи, нирок, кісток, нервової системи
- при лікуванні
Норма магнію в крові, ммоль / л
- діти до 1 року — 0,7-1,0
- діти 1-15 років — 0,1,0
- дорослі (чоловіки і жінки) — 0,7-1,0
Норма магнію в сечі, ммоль / 24години
- дорослі (чоловіки, жінки) — 1,7-8,2
Пам'ятайте, що у кожної лабораторії, а точніше у лабораторного обладнання та реактивів є «свої» норми. У бланку лабораторного дослідження вони йдуть в графі — референсні значення або норма.
Аналіз на магній проводять разом з наступними дослідженнями
- — , , , ,
- — , ,
- вітамін D
- і
- — ТТГ, вільний Т4
- і в сечі — , , , ,
8 фактів про магній
- кількість магнію усередині і поза кліткою можуть значно відрізнятися
- нормальний результат аналізу крові на магній не виключає порушення його метаболізму
- в крові циркулює сота частка загальногокількості іона в тілі
- кількість магнію в тілі людини близько 1000 ммоль або 24 грама, що становить близько 12-16 ммоль / кг маси тіла
- обмін магнію тісто пов'язаний з кальцієвих і фосфорних метаболізмом
- затримка магнію в тілі погіршує ниркові втрати калію і веде до його дефіциту, а половина випадків зниження магнію супроводжується гіпокаліємією (зниженням калію в крові)
- втрати магнію найкраще поповнювати збагаченої магнієм мінеральною водою
- в грудному молоці міститься 35 мг / л магнію
Фактори, що впливають на результат аналізу магнію
- пошкоджуючи ниркові канальці, знижують рівень магнію в — аміноглікозиди, цисплатину, амфотерицин В, циклоспорин
- при прийомі сечогінних (фуросемід) магній швидко виводиться з сечею
- глюкагон, інсулін і високі дози препаратів кальцію, гормональні контрацептиви, естрогени — знижують
- зниження під час і
Причини зниженого рівня магнію вкрові
Знижений рівень магнію в крові (гіпомагніємія , менш 0,6 ммоль / л) спостерігається при таких захворюваннях:
1. недостатнє надходження магнію в організм
- голодування, ,
- тривале парентеральне харчування
- хронічний
- надмірна кількість жирів, кальцію і недолік білків в їжі
2. втрати магнію травним трактом
- синдром — порушений процес всмоктування органічних і неорганічних речовин, при захворюваннях печінки, , , , , ,
- порушеному розщепленні жирів — жири пов'язують магній і заважають його абсорбції в кишечнику
- тривалі , блювота
- після операцій на тонкому і товстому кишечнику — зниження тимчасове, після повного видаленняділянки тонкої кишки або шлунка — постійне
- повторне видалення з черевної порожнини
3. втрати магнію через нирки
- захворювання нирок при яких магній втрачається з сечею —
- придбані або вроджені порушення реабсорбції магнію в канальцях нирок
4. перерозподіл магнію — частина іонів направляється усередину клітини, що веде до зниження концентрації в крові
- в процесі одужання, при швидкому зростанні, після внутрішньовенного введення інсуліну
- активне зростання пухлини
- активне складування магнію в кістки, так званий синдром голодної кістки (hungry bone syndrome) після операцій на прищитовидних залозах
5. інші захворювання
- знижений рівень кальцію в крові
- дефіцит фосфатів
- гемодіаліз
- післяопераційний стан
- важкі опіки
- гиперпаратиреоз
- хвороба Іценко-Кушинга (з гіперпродукцією альдостерону)
- синдром Бартера — захворювання , при якому порушено всмоктування хлоридів і натрію в ниркових канальцях, вони пов'язують воду, що призводить до підвищеної втрати магнію і кальцію сечею
Симптоми зниженого рівня магнію в крові
Симптоми гипокальциемии іноді маскує, а іноді погіршує супутня гіпомагнезіемія (низький рівень магнію в крові).
- відчуття внутрішньої напруги і натягнутості
- часте дихання з одночасним відчуттям нестачі повітря
- тремор мови і кінчиків пальців, відчуття повзання мурашок по шкірі, загальна м'язова слабкість (до повного безсилля)
- сухість у роті
- болю в області серця (навіть в сосоянии повного спокою)
- головні болі викликані спазмом м'язів голови і шей, а також внутрішньосудинних м'язових волокон
- неврастенія — дратівливість, втома, нездатність зосередитися, запаморочення, чутливість до гучних звуків
- спазми шлунку ікишечника
- нічні судоми
- тетания
Наслідки зниженого рівня магнію в крові
- магній в сечі захищає від формування деяких видів ниркових каменів, тому недолік мікроеллемента підвищує ризик
- дефіцит магнію знижує виділення кальцію з кісток
- гострий дефіцит магнію підвищує секрецію паратгормона, але тривалий — знижує (при вторинному гипопаратиреозе)
- недолік магнію значно підвищує схильність до судом і їх тяжкість
- якщо в крові низькі рівні калію, кальцію і магнію, то лікування виключно препаратами (в / в або в вигляді таблеток) з калієм і кальцієм ефективно не, в першу чергу потрібно відшкодувати магній
- недолік магнію приводить до фосфатурии і надалі до дефіциту фосфору в тілі
- дислипидемия і
- інсулінорезистентність і цукровий діабет 2типу
Причини підвищеного рівня магнію в крові
- або хронічна ниркова недостатність
- після застосування магнезія сульфату як проносний, внутрішньовенного введення магнію, після передозування вітаміну D
- масивне відмирання клітин — травми з пошкодженням м'язів, ,
- захворювання залоз внутрішньої секреції — , хвороба Аддісона(Недостатність кори надниркових залоз, знижена продукція альдостерону призводить до втрат натрію сечею і затримці калію і магнію в крові), недолік гормону росту, гіперпаратиреоз
- при гемолітичних анеміях — при руйнуванні еритроцитів магній масовано потрапляє в кров
- ,
- зневоднення
Симптоми підвищеного рівня магнію в крові
- слабкість, нудота, блювота
- низький артеріальний тиск, низька частота серцевих скорочень
- аритмії вВнаслідок зниження збудливості серцевого м'яза
- м'язова слабкість до парестезії
- сонливість
- підвищення больового порогу
Антитіла до дволанцюгової ДНК
Антитіла до дволанцюгової ДНК або аnti-dsDNA антитіла — неоднорідна група антитіл проти двухспіральной ДНК, лабораторний маркер .
Anti-dsDNA антитіла — це
аутоантитілапроти розташованої усередині ядра ДНК. Точна причина їх поява в не встановлена.
Імунна система людини виробляє антитіла — спеціальні білки, які борються з вірусами, бактеріями, грибками, різними паразитами — тобто всім, що генетично відрізняється від свого. Завдання будь-якого антитіла — знищити чужорідний матеріал, а рідні клітини не чіпати (механізм аутотолерантності).
У деяких випадках імунна відповідь спрямований не проти чужинців, а проти власних клітин і тканин. У такому випадку говорять про розвиток аутоімунного захворювання. А антитіла, які виробляються до своїх же клітин або їх компонентів називаються аутоімунними.
У разі серйозної поломки в імунітеті, рівень аутоантитіл стає підвищеним і достатнім для постановки діагнозу .
Aнтітела до двухцепочечной ДНК — це не одне антитіло, а цілий комплекс антитіл, їх мета — ДНК з ядра клітини.
Аналіз на антитіла до двуспиральной ДНК високочутливий для діагностики , тобто позитивний результат підтверджує діагноз. Антитіла до dsDNA виявляють у 70-80% хворих. Але, недостатня чутливість дослідження вимагає обережності в читанні результату аналізу (тобто негативний результат — не виключає діагнозу системного червоного вовчака).
Системна червоний вовчак
Системний червоний вовчак — важке аутоімунне захворювання з ураженням декількох органів і систем — шкіри, суглобів, серця, судин , нирок, головного мозку. Не обов'язково одночасна присутність симптомів з боку всіх цих органів. Вовчак дуже різноманітна за своїми проявами, у одного пацієнта можуть переважати ниркові, а в іншого — шкірні симптоми.
Фактори ризику розвитку системного червоного вовчака
- генетична схильність — що підтверджується наявністю у родичів хворих на системний червоний вовчак низьких рівнів аутоантитіл і деяких антигенів системи HLА
- вірусна інфекція — запускає автоімунний процес
- — ультрафіолетові промені, приводячи до апоптозу клітин шкіри, «оголюють» ДНКі роблять її видимої для імунної системи
- ліки — прокаїнамід, гидралазин, метилдопа
- гормональні зміни (, , ), викликані естрогенами і , ніж пояснюють велику частоту захворювання серед жінок (90%)
Симптоми системного червоного вовчака
- загальні прояви — слабкість і втома, болі в м'язах, суглобах, зниження ваги,підвищення температури тіла, збільшення лімфатичних вузлів
- артрит і артралгія — запалення і болючість суглобів кистей, колін, зап'ясть, на рентген знімку навколо суглоба зниження кісткової щільності (періартікулярний остеопороз) , але без ерозій
- бабочкообразная висип на обличчі та інші види висипань
- фоточувствительность — симптоми погіршуються після перебування на сонці
- серозіти — запалення серозних оболонок серця, легенів (перикардит,плеврит)
- ураження нирок (люпус нефрит) — зниження функції нирок і тріада лабораторних симптомів
— протеїнурія — втрата білка з сечею понад 0,5 г / добу (100%)
— мікрогематурія — в осаді сечі (80%)
— (45-65%)
Рідко в сечі з'являється значна кількість лейкоцитів () при відсутності інфекції сечовивідних шляхів.
- ураження легень — гострий люпус пневмоніт — асоціація лихоманки, кашлю з плямистими альвеолярними інфільтратами
- нейропсихічного прояви — від депресії до епілептиформних нападів, порушення зору і психози
- набряк сосочка зорового нерва і ватообразние вогнища на сітківці
Виявлення в крові антитіл до двуцепочечной ДНК у пацієнта на системний червоний вовчак вимагає повторного контролю через 1-3-6-12 місяців вЗалежно від ступеня тяжкості захворювання. У таких хворих підвищений ризик розвитку люпус нефриту, оскільки комплекси anti-dsDNA з імунними комплексами ушкоджують нирки.
Аналіз на anti-dsDNA антитіла проводять
- при підозрі на наявність системного аутоімунного захворювання
- при наявності симптомів системного червоного вовчака
- диференціальна діагностика суглобового синдрому
- контроль перебігу системного червоного вовчака
- прогнозування розвитку люпус нефриту
- припозитивному результаті аналізу на антиядерні антитіла
- при підозрі на наявність системного захворювання, особливо системного червоного вовчака
- при позитивному результаті дослідження антинуклеарних антитіл, ENA антитіл
- для прогнозування успішності лікування
За яких симптомах проводять визначення антитілдо двухцепочечной ДНК
- артрит — запалення суглоба, проявляється болем, набряком, порушенням рухливості, почервонінням шкіри і підвищенням температури над ним
- або неясного походження
- захворювання нирок імунного генезу або зміни в результатах (, )
- — руйнування еритроцитів з підвищеннямрівня
- тромбоцитопенія — знижене число в
- — знижене число нейтрофілів в
- шкірні симптоми — висипання, потовщення шкіри, особливо після активного впливу сонця
- синдром Рейно — періодична зміна кольору пальців стоп і кистей (блідість, посиніння і почервоніння) з порушенням чутливості і болем
- підвищення температури тіла, втома, зниження ваги,
Норми anti-dsDNA антитіл
в нормі в крові не визначаються.
цифрові норми залежать від іспользовуемих тест-систем. Аналізи на аутоантитіла потрібно проводити в одній і тій же лабораторії.
Аналіз на антитіла до двуспиральной ДНК проводять разом з наступними дослідженнями
- — , , , ,
- — , , ,
- anti-Sm антитіла
- anti-nRNP антитіла
- anti-SCL-70 антитіла
- антігістоновие антитіла
- антіцентромерние антитіла
- anti-sp100 антитіла
2 факти про anti-dsDNA антитіла
- відкриті в 1957 році, одночасно доведено зв'язок на системний червоний вовчак
- разом з ревматоїдним факторомє найбільш вивченими аутоантителами
Причини появи в крові anti-dsDNA антитіл
- системний червоний вовчак — позитивний результат дослідження є критерієм діагнозу
- лікарсько інуцірованная сісітемная червоний вовчак
- синдром Шарпа (змішане захворюваннясполучної тканини)
- ревматоїдний артрит — присутні в рідкісних випадках, зникають в разі успішного лікування, антитіла abti-dsDNA можуть з'являтися після лікування анти-ФНП-альфа препаратами (адалімумаб , інфліксімаб, етанерцепт) — тимчасово, пов'язане з підвищеним ризиком появи червоного вовчака синдрому
- парвовірусна інфекція
найбільш часті питання про антитіла до дволанцюгової ДНК
1. Чи варто здавати аналізи на anti-dsDNA якщо у мене не виявлено антиядерні антитіла?
Ні, аналіз здавати потрібно. Антиядерні антитіла можуть бути негативними у пацієнтів на системний червоний вовчак і позитивними anti-dsDNA.
2. При позитивних anti-dsDNA у мене негативні ANA. Значить у мене немає системного червоного вовчака?
Результати будь-яких лабораторних досліджень, а при системних аутоімунних захворюваннях — особливо, варто оцінювати лише комплексно. На першому місці — симптоми, а потім — лабораторні тести. У частини пацієнтів на системний червоний вовчак позитивні anti-dsDNA і негативні ANA. Спрощений алгоритм розшифровки виглядає наступним чином:
- позитивні anti-dsDNA — критерій діагнозу системного червоного вовчака
- негативні anti-dsDNA — не підтверджують відсутність хвороби
3. У мене системний червоний вовчак. Коли-небудь антитіла до дволанцюгової ДНК повністю зникнуть з моєї крові?
Ні. Їх рівень може підвищуватися і знижуватися в залежності від успішності лікування і способу життя. У мінімальних кількостях anti-dsDNA будуть в крові під час ремісії, максимум — при загостренні.
4. У мене виявлені антитіла до дволанцюгової ДНК, але при цьому відчуваю себе прекрасно, немає ніяких симптомів системного червоного вовчака. Так може бути?
Так. Незначні кількості anti-dsDNA можуть виявлятися в крові здорових людей. Але, таке явище тимчасове, антитіла представлені імуноглобулінами М з низькою авідності (ступенем міцності з'єднання антигену і антитіла), а не IgG з високою авідності, як при системний червоний вовчак.
Онкомаркери раку легенів
Онкомаркери — це особливі речовини, які є результатом життєдіяльності клітин раку. Існує безліч онкомаркерів різних за своєю природою, проте велика частина з них є білком або його похідними.
Зазвичай їх можна виявити в крові і сечі хворих на рак пацієнтів, і на основі кількісно-якісних показників зробити висновок про наявність, вигляді і стадії розвитку раку.
Здавалося б здатні дати відповідь на всі питання, але до жалі на практиці це не завжди так.
Справа в тому, що точність даних, отриманих з їх застосуванням, безпосередньо залежить від двох характеристик: специфічність і чутливість.
Специфічність онкомаркера — це зв'язаність маркера з одним конкретним онкозахворюванням. Наприклад, якщо маркер не володіє специфічністю, то з його допомогою можна виявити онкозахворювання, проте не можна зробити висновок про його різновиди: рак чи це легких, печінки або будь-якої іншої.
Чутливість онкомаркера — здатність маркера виявляти захворювання і відображати його розвиток. Слабка чутливість маркера означає його нездатність дати інформацію про присутність і ступеня розвитку пухлинних процесів в організмі пацієнта. Тобто саме по собі наявність такого маркера в крові або сечі не говорить про те, що людина хвора.
В даний час специфічність і чутливість маркерів різна для різних видів раку, однак жоден з них не володіє 100% показниками.
Онкомаркери раку легенів
Оскільки більшість злоякісних пухлин легенів гетерогенних за гістологічної структурі, Європейська група по онкомаркерів (EGTM) рекомендує для діагностики і контролю застосовувати наступні онкомаркери :
- або карціноідоембріональний антиген (CEA)
- (NSE)
- фрагмент цитокератину 19 (Cyfra-21-1 )
При цьому,в залежності від гістологічної будови пухлини рекомендований до використання наступні комбінації маркерів:
- дрібноклітинна карцинома (МКРЛ): NSE і
- недрібноклітинному карцинома (НДКРЛ): Cyfra 21-1 і РЕА
- аденокарцинома: Cyfra 21-1
- плоскоклеточная карцинома: Cyfra 21-1 і РЕА
- крупноклеточная карцинома: Cyfra 21-1, NSE і РЕА
Зазначені вище маркери можуть використовуватися при діагностиці пацієнтів, які отримують спеціальне лікування або перенесли операцію налегких.
Лікарі, використовуючи їх інформацію в комплексі з іншими методами діагностики, здатні розпізнати прогресування хвороби ще до появи виражених клінічних ознак і відповідно скоригувати схему лікування.
Так збільшення показника маркера вдвічі протягом нетривалого періоду часу (1-2 місяці) найчастіше свідчить про злоякісному рості. Однак слід враховувати, що якщо тести проводилися під час або після хіміотерапії, зростання онкомаркерів не завжди свідчить про розвиток хвороби.
Справа в тому, що успішне лікування супроводжується масовою і швидкою загибеллю пухлинних клітин, в результаті чого в кров надходить значна кількість онкомаркерів. В такому випадку підвищення показників є сприятливою ознакою та свідчить про вдале виборі комбінації препаратів для хіміотерапії.
Проводячи дослідження на основі , для правильної інтерпретації їх результатів, необхідна консультація відповідного лікаря. Під час такої консультації не зайвим буде з'ясувати його думку щодо наступних питань:
- виявлено чи підвищене значення рівня маркерів?
- які конкретно маркери мають підвищений рівень?
- що може означати таке підвищення?
- приймається до уваги при виборі методів лікування дані такого дослідження?
- чи слід внести корективи в схему лікування , покладаючись на отримані дані?
лейкемоїдні реакції
Лейкемоїдні реакції — це
стани, що виникають в результаті впливу на костномозговое кровотворення запального, пухлинного процесу, токсичних речовин і інших факторів .
Це не гематологічне захворювання, проте зміни з боку можуть бути настільки значними, що виникає необхідність відрізнити їх від і інших пухлинних захворювань системи крові.
Типи лейкемоїдна реакцій
При нейтрофільною лейкемоідной реакції в крові відзначається високий , до промиелоцитов і навіть мієлобластів, збільшення . Однак поява великої кількості бластних елементів в периферичної крові не типово для лейкемоідних реакцій, відсутні при них і інші зміни, характерні для гострих лейкозів і хронічних лейкозів.
В миелограмме відзначається порушення лейкоерітроцітарного співвідношення (збільшення за рахунок подразнення мієлоїдного паростка).
гранулоцитарних лейкемоїдні реакції
спостерігаються при , сепсисі, , , важкої , злоякісних пухлинах, лікарської інтоксикації, вплив фізичних факторів.
Еозинофільний тип лейкемоідних реакцій
зустрічається при різних , , псоріазі, лускатим лишаї, пухлинах і т.д. При цьому відзначається збільшення кількості в периферичної крові більше 0,4 • 10 9 / л. При помірному ступені еозинофілії число еозинофілів складає 10 — 15% в .
моноцитарна лейкемоїдні реакції
можливі при хронічної інфекції (, туберкульозі та інших захворюваннях). Вони характеризуються збільшенням кількості моноцитів понад 0,8 • 10 9 / л.
лімфоцитарний лейкемоїдні реакції
спостерігаються при інфекційному лімфоцитозі, , іноді при дитячих інфекціях (скарлатині, ), злоякісних пухлинах, вірусних захворюваннях.
Лімфоцитарна реакція проявляється збільшенням кількості лімфоцитів понад 4 • 10 9 / л (4000 / мкл), у дітей більше 9 • 10 9 / л.
Допомагає у вирішенні питання про наявність лейкемоідной реакції виявлення причин, що викликають ці реакції, а також аналізи мазків кісткового мозку та цитохимический аналіз. Зазвичай ефективне лікування основного захворювання призводить до нормалізації клітинного складу крові.
Аналізи при раку передміхурової залози
Рак передміхурової залози
Це друга за поширеністю злоякісна пухлина у чоловіків. Хворіють частіше люди у віці 45 — 50 років, до 80 років частота цього захворювання зростає. Рак передміхурової залози відрізняється повільним зростанням і тривалим безсимптомним перебігом.
Діагностика раку передміхурової залози грунтується на результатах пальпації залози, лабораторних даних і трансуретральна УЗД.
Загальний аналіз крові і сечі в межах норми і лише приєднання вторинної інфекції (цистит, пієлонефрит) викликає відповідні зміни.
Аналізи при раку передміхурової залози
Аналізи на онкологічні маркери мають вирішальне значення в діагностиці раку передміхурової залози. Маркерами раку передміхурової залози є і простатическая кисла фосфатаза. Ці маркери дозволяють здійснювати ранню діагностику і моніторинг. Визначення простатичної кислої фосфатази, в основному, використовується з прогностичної метою (рівень підвищується при метастазах в кістки).
Простатспеціфіческій антиген є тканеспецифическим маркером саме передміхурової залози. У клініці визначається загальний ПСА, пов'язана і вільна форма ПСА.
Нормальна — 0-4 нг / мл. При доброякісної аденомі передміхурової залози і запаленнях простати (гострому простатиті, хронічному простатиті) рівень ПСА перевищує норму: у віці 70 — 79 років він становить 0 — 4,8 нг / мл, а в 80 років і старше — до 8,8 нг / мл.
Прийнято вважати, що при концентрації ПСА, що дорівнює 10 нг / мл і вище, імовірна доброякісна гіперплазія (при відсутності інших змін). Концентрація ПСА в 30 нг / мл виразно свідчить про рак передміхурової залози. Однак при раку спостерігаються і більш низькі значення ПСА, але одночасно і збільшення вмісту? -антіхімотріпсіна. При цьому значно збільшується рівень пов'язаної і знижується вільної фракції ПСА (при значенні загального ПСА вище 4 нг / мл).
Для діагностики велике значення має не тільки визначення вільної фракції (зміст її при раку нижче, ніж при доброякісної гіперплазії передміхурової залози), але і величина відносини її до загального ПСА. При значеннях показника нижче 0,15 виникає припущення про рак передміхурової залози.
Значення ПСА в діагностиці раку передміхурової залози
- при величині ПСА більше 20 нг / мл можна підозрювати рак,
- величина ПСА більше 50 нг / мл вказує в більшості випадків на екстракапсулярно інвазію та ураження регіонарних лімфатичних вузлів,
- величина ПСА більше 100 нг / мл показник метастазування.
Додаткові діагностичні критерії при раку передміхурової залози
- швидкість щорічного збільшення ПСА в нормі не повинна перевищувати 0,75 нг / мл (за іншими даними 1,36 нг / мл на рік),
- щільність ПСА (відношення загальної ПСА до об'єму передміхурової залози) не повинна перевищувати 0,15 нг / мл на 1 см 3 залози (при відсутності вузлів і величиною простатспецифического антігена4 -20 нг / мл).
Аналіз змісту ПСА в крові після простатектомії рекомендується проводити не раніше, ніж через 2 -3 міс.
Необхідно підкреслити, що такі процедури, як пальпація, пункція, цистоскопія, колоноскопія викликають збільшення ПСА, більш виражене на наступний день, особливо у хворих на доброякісну гіперплазію передміхурової залози.
Пункційна біопсія передміхурової залози проводиться в наступних випадках:
- у всіх випадках при ПСА вище 30 нг / мл,
- при виявленні ущільнення пальпаторно або УЗД. Отриманий матеріал, крім гістологічного аналізу, може бути використаний для визначення прогестерон-рецепторів.
З урахуванням всього вище викладеного всі чоловіки старше 45 років повинні відвідувати уролога щорічно, а пацієнти з будь-якої захворюванням з боку простати — не рідше двох разів на рік з контролем рівня ПСА.
Аналізи при залізодефіцитної анемії
Залізодефіцитна анемія — захворювання, що виникає в результаті нестачі . Про діагностику анемій читайте .
розвивається внаслідок недостатності надходження , порушень його всмоктування після резекції шлунка і кишечника, при хронічному ентериті, підвищеній потребі під час , , в період , впливу і інших причин. Будь-які порушення обміну заліза ведуть до розвитку анемії.
Але найпоширенішою причиною є крововтрати, іноді рясні або повторні, частіше приховані. Вони ведуть до виснаження запасів заліза в організмі і поступового розвитку залізодефіцитної анемії. Хронічні крововтрати мають різне походження: маткові (менорагії, фіброміоми), шлунково-кишкові (, грижа стравохідного отвору діафрагми, , пухлини та ін.), Легеневі та інші.
Дефіцит заліза в організмі може бути латентним, прихованим при нормальному рівні і . Для залізодефіцитної анемії характерно зниження всіх резервів заліза та рівня гемоглобіну та еритроцитів.
. У першу чергу, слід відзначити зниження кількості еритроцитів, гемоглобіну і величини (гіпохромна анемія), причому, концентрація гемоглобіну знижується різкіше, ніж число еритроцитів. Зменшується і , відзначається Анізія і пойкилоцитоз — різні діаметр еритроцитів і форма. Кількість нормальне або злегка підвищений (при крововтратах), зміст їх зростає при призначенні препаратів заліза. Важкі і тривалі анемії викликають і відносний .
відображає зміни, викликані основним захворюванням.
. Вирішальне діагностичне значення мають показники аналізу обміну заліза — різко знижується вміст і насичення залізом , нормальна або вище норми.
Виведення дісферала (діагностичний тест) підвищено, що вказує на зниження запасів заліза в організмі.
При прихований дефіцит заліза зміст знижено, що пов'язано зі зниженням рівня транспортного заліза, підвищена.
Аналіз кісткового мозку — відзначається зниження кількості сидеробластов і збільшення поліхроматофільних нормобластов.
Anti-SSA і anti-SSB антитіла
Anti-SSA і anti-SSB антитіла (аnti- Sjogren's-syndrome-related antigen A або anti-Ro і аnti-Sjogren's-syndrome-related antigen B або anti-La) — показники наявності системного захворювання, найбільш специфічні для і .
Anti-SSA і anti-SSB — це
аутоантитіла проти компонентів ядра і цитоплазми клітини. Їх поява в крові пов'язано з порушенням процесу раcпознаванія імунною системою своїх і чужих клітин.
Anti-Ro і anti-La — це неоднорідний за структурою антигенний комплекс, утворений трьома різними білками — 52 кДа — Rо (в ядрі і полісом), 60 кДа — La (в цитоплазмі) і чотирма РНК частинками.
Anti -SSA і anti-SSB антитіла визначають разом. Якщо в є abnti-SSA, то проводиться аналіз на anti-SSB, без перших — другі відсутні. Причини появи даних антитіл точно не відомі. Сприятливі фактори: ультрафіолетові промені, оксидативний стрес, препарати TNF-альфа і , вірусна інфекція. Носії антигенів мають підвищений ризик розвитку синдрому подовженого інтервалу QT з більш частими аритміями.
Наявність антитіл anti-SSA, anti-SSB асоційоване з наступними симптомами і захворюваннями
- подострая шкірний червоний вовчак (SCLE )
- фоточувствительность
- шкірний
- зміни картини крові (, , )
- інтерстріціальние захворювання легенів
Синдром Шегрена
Синдром Шегрена — системне хронічне захворювання з поступовимпорушенням функції слинних і слізних залоз, проявляється постійною сухістю в роті і сухими коньюнктивита.
Виділяють два види синдрому Шегрена:
- первинний — самостійна патологія, при якій знаходять anti-SSA і anti-SSB в крові
- вторинний — супроводжує інші аутоімунні захворювання — ревматоїдний артрит, системна червоний вовчак, синдром Шарпа, системні васкуліти, наявність антитіл необов'язково
Причина появи синдрому Шегрена невідома. Ймовірна роль вірусів (, ), поєднання деяких генів системи HLA.
Симптоми синдрому Шегрена
- ксеростомия, дисфагія
- печіння і відчуття чужорідного тіла в очах, світлочутливість
- знижене виділення поту, сухість шкіри, постійна сверблячка шкіри, зниження оволосіння
- гастрит з низьким рівнем хлорної кислоти
- недостатність
- гепатопатия
- сухість піхви і зовнішніх статевих органів, часті
- , інтерстиціальна пневмонія
- васкуліти і артрити
Діагностичні критерії синдрому Шегрена
- сухий кератоконьюнктівіт (підтверджений тестом Ширмера)
- ксеростомия
- при біопсії слинних залоз- Інфільтрація лімфоцитами
- позитивні результати дослідження антитіл — ревматоїдний фактор, антинуклеарні антитіла, ENA антитіла
Аналіз на anti-SSA і anti-SSB антитіла проводять
- при підозрі на наявність системного захворювання, особливо синдрому Шегрена і системний червоний вовчак
- при позитивному результаті дослідження антинуклеарних антитіл, ENA антитіл
- для прогнозування успішності лікування
За яких симптомах проводять аналіз на anti-SSA і anti-SSB антитіла
- сухість слизової оболонки очей і рота, шкіри тіла
- потовщення і затвердіння слинних залоз
- порушення ковтання
- часті сухі кератокон'юнктивіти
- хворобливість, набряклість і почервоніння суглобів, рання скутість
- хронічний бронхіт, інтерстиціальна пневмонія
Норми anti-SSA і anti-SSB
у нормі anti-SSA і anti-SSB в крові не визначаються .
Цифрові норми залежать від іспользовуемих тест-систем. Аналізи на аутоантитіла потрібно проводити в одній і тій же лабораторії.
Аналіз на anti-SSA і anti-SSB проводять разом з наступними дослідженнями
- — , , , ,
- — , , ,
- anti-Sm антитіла
- anti-nRNP антитіла
- anti-SCL-70 антитіла
- anti-dsDNA антитіла
- антігістоновие антитіла
- антіцентромерние антитіла
5 фактів про anti-SSA і anti-SSB антитіла
- є імуноглобулінами G
- вперше описані в 1961 році
- виявляють у 0,1-0,5% здорових людей
- визначення anti-SSA і anti-SSB у афроамериканців — вказівка на несприятливий прогноз і тяжкий перебіг системногозахворювання
- часто виявляють у осіб з негативним аналізом на антиядерні антитіла
Причини появи в крові anti-SSA і anti-SSB
1. первинний синдром Шегрена — діагностичний маркер захворювання і критерій класифікації. Виявляють у 70-100% хворих.
Практично всі хворі з синдромом Шегрена і позитивними антитілами мають симптоми поза слинних і слізних залоз — збільшення лімфатичних вузлів, печінки, васкуліти, висип, змінену картину крові.
Виявляються раніше, ніж інші антитіла ( anti-dsDNA, anti-RNP, anti-SM) за 3-6 років до перших симптомів вовчака. Таким чином позитивний результат аналізу можна вважати позитивним щодо пізнього появи проявів хвороби.
2. системний червоний вовчак (40-90%) — мультисистемні аутоімунне захворювання з широким спектром поліклональних антитіл в крові.
3. неонатальна червоний вовчак (вроджений вовчаковий синдром) — захворювання плода та новонародженого придбане від матері з системним аутоімунним захворюванням і з позитивними anti-SSa і anti-La антитілами.
Антитіла SSA і SSB здатні проникати до плоду з моменту формування плаценти (приблизно 10-12 тиждень вагітності). Найбільш небезпечне ускладнення — повна блокада серцевої провідності в третьому триместрі і після народження з незворотною зупинкою серця (1-5% в перших пологах, до 25% — при повторних). Чим вище рівень антитіл, тим вище ризик блокади.
Симптоми неонатальної червоного вовчака
- висип на шкірі
- тромбоцитопенія
- лейкопенія
- анемія
- порушення функції печінки
- самостійно проходить через 6 місяців після народження
- вроджена блокада серця — у 1-5%
4. (3-15%) — з симптомами синдрому Шегрена, більш часті ускладнення при лікуванні препаратами золота і Д-пеніциліном
5. (5-15%)
6. ANA-негативна системний червоний вовчак
7. артрит Жаку — форма ревматоїдного артриту з деформацією суглобів без ознак ерозії на рентгнограмме
8. (30%)
9. нефрити, , лейкопенія
10. вроджена недостатність C2 і C4 компонентів системи комплементу
11. (3-11%) — показник більш тяжкого перебігу
Лабораторний аналіз сперми
При , яке професійною мовою лікарів називається спермограми , виділяють три етапи: оцінка фізичних параметрів, аналіз хімічних показників, мікроскопія — вивчення сперми під мікроскопом.
Фізичні властивості сперми
Колір еякуляту коливається від жовтуватого до білого. Якщо в спермі багато лейкоцитів, вона буде гнійного характеру, а при збільшенні — червонуватого кольору. Якщо еякулят НЕ розріджується, значить в ньому багато слизу. Якщо він дуже рідкий, це може бути при закупорці сім'явивідних протоки, тобто тоді, коли в ньому немає секрету насінних бульбашок. Якщо еякуляту більше 5 мл, це називається поліспермії і трапляється при захворюванні простати і сім'яних пухирців.
Еякулят об'ємом менше 1 мл завжди є патологічним і, як правило, не містить сперматозоїдів. Таке виникає при гормональної недостатності яєчок, тобто недостатнім вмістом тестостерону.
В'язкість також, до певної міри, визначає здатність до запліднення сперми. Найпростіший метод визначення в'язкості за допомогою скляної палички. Остання занурюється в сперму і, якщо на паличці залишається крапля сперми, значить в'язкість нормальна. При зниженій в'язкості краплі сперми на паличці немає. Якщо в'язкість підвищена, від поверхні сперми за паличкою тягнеться довга нитка, яка відривається з працею. Визначення в'язкості має значення при зниженій рухливості сперматозоїдів.
Реакція сперми — слаболужна . Концентрація іонів водню коливається в межах 7,2-7,6 рН. Від реакції залежить рухливість сперматозоїдів — в кислому середовищі рух різко сповільнюється. Так як реакція середовища піхви кисла (рН 4-5), лужна реакція сперми нейтралізує середу піхви і сприяє просуванню сперматозоїдів до шийки матки, де середовище лужне.
Нормальним кількістю сперматозоїдів в спермі вважалося раніше 70-100 млн. Однак , за даними Всесвітньої Організації Охорони здоров'я, останнім часом вважається нормальним і меншу кількість, а саме 20 млн в 1 мілілітрі. Зміна в бік зменшення сперми називається олігоспермією , а збільшення — поліспермії .
Кількість сперматозоїдів менше 1 млн. Говорить про андрогенної недостатності . Як то, так і інше може позначитися на запліднюючої здатності сперми.
Дуже важливим показником є кількість сперматозоїдів в 1 мл . Навколо цього питання довгий час велася дискусія. В даний час загальновизнано, що найкращі шанси на запліднення має сперма з кількістю сперматозоїдів 100 млн. в 1 мл, кількість патологічних форм не повинно перевищувати 20%, кількість рухомих форм має становити 60-75% через 2 години після отримання еякуляту і 25% — через 6-8 годин.
За даними багатьох учених, ефективна плодючість людини оцінюється в 42%, тобто з 100 запліднених яйцеклітин гине 58. Близько 90% запліднених яйцеклітин гине в результаті хромосомних неполадок, тобто генетичного шлюбу в статевих клітинах як чоловіків, так і жінок. Невелика частина «бракованих» ембріонів, тобто хромосомних мутантів, все ж розвивається, але, на жаль, виявляється неповноцінною, що веде до мимовільного переривання вагітності в ранньому терміні. У такому випадку жінка навіть не підозрює про те, що була вагітна, а позачергову менструацію сприймає як банальне порушення циклу.
В даний час налічується близько 1500 вроджених захворювань , однак не всі вони носять спадковий характер. Багато з них пов'язані з неправильним розвитком зародка в результаті різних захворювань матері або батька, а також впливу екзогенних і ендогенних шкідливих факторів, як вживання алкоголю, наркотиків, куріння, впливу радіонуклідів та інших хімічних речовин.
Практичне значення при аналізі сперми має визна ня фруктози , яка впливає на клітини Лейдіга , від функції яких залежить вироблення тестостерону. Крім того, фруктоза є як би енергетичним матеріалом. Швидкість розщеплення фруктози (фруктоліз) і використання її сперматозоїдами дозволяє судити про обмін речовин і життєздатності сперматозоїдів. Чим більше кількість сперматозоїдів, чим активніше їх життєздатність і рухливість, тим інтенсивніше протікає фруктоліз.
Таким чином, тривалість запліднюючої здатності сперматозоїдів залежить від кількості фруктози і здатності сперматозоїдів до фруктолізу.
Визначення кількості, морфології і рухливості сперматозоїдів не завжди характеризує їх фертильність.
Біохімічесскій аналіз сперми для оцінки фертильності
біохімічне дослідження еякулята включає визначення вуглеводного, білкового, амінокислотного, електролітного і ферментного складу еякуляту.
Найбільше значення має визначення фруктози і лимонної кислоти . Фруктоза впливає на клітини Лейдіга, від яких залежить вироблення тестостерону, і, крім того. фруктоза служить енергетичним матеріалом. Швидке розщеплення фруктози (фруктоліз) і використання її сперматозоїдами дозволяє судити про обмін речовин і життєздатності сперматозоїдів. Лимонна кислота є об'єктивним тестом функціональної активності передміхурової залози і в нормі в еякуляті міститься 22,5-30 ммоль / л.
Для визначення андрогенної функції використовують фосфатазной індекс . Це — ставлення кислої фосфатоза до лужної. Якщо індекс вище 0,3 — це свідчить про підвищену андрогенної насиченості, 0,1-0,3 — нормальної і нижче 0,1 зниженою.
Звичайно, найбільш точним методом, визначальним андрогенную насиченість, є лабораторне визначення кількості тестостерону в плазмі .
При радіоімунним методі вміст тестостерону в плазмі крові становить 26-48 ммоль / л. Зниження андрогенів в плазмі крові спостерігається у 60-70% хворих секреторне безпліддям і у 80-90% — поєднаним.
Зниження екскреції вказує або на гипогонадизм будь-якої етіології, або на вікову інволюцію або чоловічий клімакс. Для чоловіків 20-50 років загальні 17-кетостероїди складають 49,9 мк / моль. Відомо, що в результаті недостатності яєчок посилюється продукція статевих стероїдів надниркових залоз. Надлишок естрогену пригнічує метаболізм тестостерону в передміхуровій залозі та інших статевих органах, що забезпечують репродукцію.
Гіперестрогенурія спостерігається при різних формах гипогонадизма, крипторхізмі, синдромі Клайнфельтера, особливо в поєднанні з генікомастія.
Збільшення естрогенів може спостерігатися при неправильному проведенні стимулюючої та замісної терапії тестостероном.
Велике теоретичне і практичне значення мають імунологічні аспекти чоловічого безпліддя . Етіологічними факторами аутоиммунизации може бути цілий ряд таких. Це, зокрема, — зміни рН-середовища, гарячковий стан з високою температурою, ішемія і гіпоксія яєчок, авітаміноз, лікарські речовини, інфекційні агенти, хронічні запалення в придаткових залозах.
У хворих на хронічний простатит в 50% випадків визначаються аутоантитіла до тканин простати, яєчка і сперматозоїдам.
Без урахування імунологічних зрушень не можна отримати повного уявлення про походження патоспермії — зміненого складу сперми .
Існує багато біохімічних досліджень, однак одні з них перебувають у вивченні, інші практичного значення у визначенні запліднюючої здатності сперматозоїдів не мають.
Мікроскопія еякуляту
Велике значення надається мікроскопічному дослідженню сперми. При цьому визначають кількість сперматозоїдів в 1 мл і у всьому еякуляті, визначають патологічні сперматозоїди, їх рух, кількість лецитинових зерен, лейкоцитів, еритроцитів, епітелію сім'явивідних шляхів, мікрофлору, спермагглютінаціі, незрілі сперматозоїди. У нормі в 1 мл міститься 60-120 млн. Сперматозоїдів. Концентрація понад 250 млн. / Мл вважається ненормальною (полізооспермія) і розцінюється як несприятлива для плодючості.
Розрізняють три ступеня олигозооспермии — малу кількість сперматозоїдів в спермі
- I ступінь — концентрація сперматозоїдів 40-59 млн. / мл,
- II ступінь-20-39 млн. / мл.
- III ступінь-1-20 млн. / мл.
Відсутність сперматозоїдів в еякуляті при наявності клітин сперматогенезу називається азооспермией , а при відсутності сперматозоїдів і клітин сперматогенезу — аспермію . Останнє не можна плутати з асперматизм, тобто станом, при якому не відбувається еякуляції. Статевий акт в таких випадках може тривати надто довго без еякуляції.
Активний рух сперматозоїдів має велике значення в заплідненні. Для оцінки рухливості сперматозоїдів запропонована п'ятибальна система:
- відсутність рухів — 0
- сіпаються на місці сперматозоїди — 1 бал
- мляве, що не прогресуюче рух вперед — 2 бали
- гарне прогресуюче рух вперед — 3 бала
- дуже швидке доцільне рух вперед — 4 бали
Нормальним вважається такий рух, при якому 70 80% сперматозоїдів відповідає 3-4 балам. Зменшення відсотка активних сперматозоїдів називається астенозооспермією , а зменшення до 1-10% — акінозоосперміей .
Живих сперматозоїдів має бути 80-90%, а мертвих -10-20%. Наявність в еякуляті 80-90% мертвих сперматозоїдів називається некроспермією .
Патологічно змінених сперматозоїдів має бути не більше 30% (15% — патологія головки, 10% — патологія шийки, 5% — патологія хвоста). Збільшення патологічних форм позначається як тератозооспермия .
Перестиглі сперматозоїди характеризуються наявністю вакуолей в голівці, які з'являються при тривалому утриманні. Вважають, що незрілі і перестиглі сперматозоїди не грають істотного значення при заплідненні, проте це є несприятливою ознакою.
Збільшення клітинних елементів сперматогенезу понад 5% свідчить про патологію сперматогенезу . До клітинних елементів відносять сперматогінні , сперматоціти , сперматіди .
Наявність в еякуляті понад 8 лейкоцитів розцінюється як піоспермія . Це ознака простатиту, запалення насіннєвих пухирців або придатка яєчка. Піоспермія характерна для екскреторно-токсичного безпліддя. Гемоспермія — підвищена кількість еритроцитів в еякуляті, буває при запаленні задньої уретри, зокрема насіннєвого горбка або насінних бульбашок.
Бактерій, грибків і склеювання сперматозоїдів нормі — в еякуляті не повинно бути.
антинуклеарних антитіла
Антинуклеарні антитіла — загальна назва групи різнорідних антитіл спрямованих проти різних компонентів клітини, виявлення їх асоційоване з аутоімунними захворюваннями, переважно .
Синоніми: , антинуклеарних фактор, антиядерний фактор, антитіла до екстрагуються ядерним (нуклеарним) антигенів, antinuclear antibodies, Hep-2 substrate, ANA-Hep2, fluorescent antinuclear antibody detection, ANA, FANA
Антинуклеарні антитіла — це
великий комплекс антитіл (більше 200), переважно імуноглобуліни G (рідше IgМ і IgА), які з'являються в результаті порушення механізму аутотолернатності при аутоімунних і ревматичних заболеваних.
Імунна система людини виробляє антитіла — спеціальні білки, які борються з вірусами, бактеріями, грибками, різними паразитами — тобто всім, що генетично відрізняється від свого. Завдання будь-якого антитіла — знищити чужорідний матеріал, а рідні клітини не чіпати (механізм аутотолерантності)
У деяких випадках імунна відповідь спрямований не проти чужинців, а проти власних клітин і тканин. У такому випадку говорять про розвиток аутоімунного захворювання. А антитіла, які виробляються до своїх же клітин або їх компонентів називаються аутоімунними .
У більшості людей є в крові незначне (!) Кількість аутоантитіл, які не є проявом хвороби.
Тільки в разі серйозної поломки в імунітеті, рівень аутоантитіл стає підвищеним і достатнім для постановки діагнозу.
ANA може бути позитивним ще до появи перших симптомів. Близько 95% пацієнтів на системний червоний вовчак мають антиядерні антитіла. Наявність симптомів вовчака підтверджує діагноз.
Механізм утворення антиядерних антитіл
- вплив ультрафіолетових променів на шкіру в результаті відбувається активація процесів запрограмованої загибелі клітини (апоптозу), що є нормальною реакцією організму, але при системних захворюваннях відбувається ще й посилена міграція
- компоненти клітини, які були раніше недоступні і невидимі для імунної системи, такі як ядерця, гістони, оболонка ядра та ін. «Оголюються», а макрофаги, замість того, щоб даний матеріал просто «утилізувати», передають сигнал про нього по ланцюжку імунної відповіді
- В-лімфоцити, у відповідь на сигнал макрофаги, починають виробляти антиядерні антитіла , які зв'язуючись з відповідним ангігеном утворюють імунні комплекси (ядерний антиген + антитіло IgG, IgM, IgA)
- імунні комплекси відкладаються на базальній мембрані різних органів і тканин, особливо судин, активація системи комплементу — місцевогозапальної відповіді
- пошкодження з порушенням функції органу
Антинуклеарні антитіла спрямовані проти різних структур нормальної клітини.
Види антинуклеарних антитіл:
- anti-Ro (SS-A) — антитіла до білків пов'язаних з РНК Y1-Y5 в сплайсосома
- anti -Jo1 — антитіла до цитоплазматичної антигену Jo-1
- anti-Sm
- anti-La (SS-B) — антитіла до білку, пов'язаному з РНК-полімераза-3
- anti-Sci 70 — антитіла доядерної топоізомерази
- anti-U1 RNP — антитіла до U1 рибонуклепротеіну
- антіцентромерние антитіла
- антігістоновие антитіла
Аналіз на антинуклеарні антитіла призначається
- підозра на наявність системного червоного вовчака, синдрому Шерги
- при наявності одного системногозахворювання і підозрі на появу іншого (наприклад, системний червоний вовчак та антифосфоліпідний синдром)
За яких симптомах варто визначати антінуклеание антитіла ?
- артрит — запалення суглоба, проявлятися болем, набряком, порушенням рухливості, почервонінням шкіри і підвищенням температури над ним
- або неясного походження
- захворювання нирок імунного генезу або зміни в результатах (, )
- — руйнування з підвищенням рівня
- тромбоцитопенія — знижене число в
- — знижене число нейтрофілів в
- шкірні симптоми — висипання, потовщення шкіри, особливо після активного
- синдром Рейно — періодична зміна кольору пальців стоп і кистей (блідість, посиніння і почервоніння) з порушенням чутливості і болем
- підвищення температури тіла, втома, зниження ваги,
Види дослідження антинуклеарних антитіл
Існує два методи визначення антинуклеарних антитіл в крові:
1. Непряма імунофлуоресцентний мікроскопія (FANA — fluorescent antinuclear antibody test) на препараті Hep-2 клітин (клітинна лінія, отримана з аденокарциноми гортані) — антинуклеарні антитіла (при їх наявності) зв'язуються з антигенами клітин Hep- 2, додають спеціальні світяться мітки, що приєднуються до освіченій комплексу і під мікроскопом дивляться інтенсивність і тип світіння. Кращий метод дослідження антинуклеарних антитіл . Інша назва — .
Результат дослідження пишуть у вигляді титру — максимального розведення крові, при якому видно світіння, також описується тип флуоресценції (в разі позитивного результату) . Чим більше антитіл, тим вище титр. Низькі титри вважаються негативними, а високі позначають підвищену концентрацію антиядерних антитіл.
Типи флуоресценції при оцінці ANA:
- гомогенний (дифузний, однорідний) — при системний червоний вовчак, змішаних захворюваннях сполучної тканини (MCTD)
- зернистий (гранулярний) — при системний червоний вовчак, синдромі Шегрена, склеродермії, , ревматоїдному артриті і MCTD — самий неспецифічний
- ядерцевих (нуклеолярний) — при склеродермії і поліміозиті
- центромерная — при склеродермії і CREST синдромі
- цитоплазматический — дерматоміозит, поліміозит, аутоімунні захворювання печінки, первинний біліарний цироз
Приклад позитивного результату дослідження антиядерних антитіл: « Позитивний розведення / тітр1: 320, гомогеннакартина ".
Алгоритм дій лікаря після дослідження антиядерних антитіл методом FANA
- негативний результат аналізу на антиядерні антитіла + симптоми — провести аналізи: anti-Ro і anti-Jo1
- позитивний результат аналізу на антиядерні антитіла + наявність / відсутність симптомів — провести аналізи на anti-DNA, anti-Sm, anti-Ro, антігістоновие і антіцентромерние антитіла, , anti-Sci-70, anti-U1 RNP, anti-Jo1 — залежить відпроявів захворювання
2. Ферментний імунний аналіз (ELISA) — антитіла, присутні в крові, зв'язуються з відповідним антигеном, що призводить до зміни кольору розчину.
- менш 1.0 U — негативний результат (норма)
- 1.1-2,9 U — слабо позитивний (вимагає повторення)
- 3,0-5,9 U — позитивний
- більше 6,0 — різко позитивний
Позитивний результат аналізу на антинуклеарні антитіла — це не діагноз, а знак оклику про необхідність додаткових аналізів. Вимагає періодичного, більш ретельного обстеження, для максимально раннього виявлення можливого захворювання.
Негативний результат дослідження на антинуклеарні антитіла вказує на їх відсутність в крові, але не виключає діагноз аутоімунного захворювання.
Аналіз на антінуклеание антитіла проводять разом з наступними дослідженнями
- загальний аналіз сечі
- — , , , ,
- ревмопроби- , швидкість осідання еритроцитів (ШОЕ),
- циркулюючі імунні комплекси
- С3 компонент комплементу
- С4 компонент комплементу
5 фактів про антинуклеарних антитіла
- аналіз на антінуклерниеантитіла — універсальний тест для всіх хворих з системними захворюваннями
- застосовується з 1957 року, в широкій практиці — від кінця 80-х років
- при наявності грудних імплантів підвищений титр антиядерних антитіл виявляють у 5-55% пацієнток
Що впливає на результат аналізу?
- лікарські препарати — прокаїнамід, фенітоїн, пеніцилін, гидралазин
- ГРЗ і застуда, будь-яке гостре або хронічне інфекційне захворювання
Причини появи антинуклеарних фактора в крові
1. Системні захворювання сполучної тканини
- — 95-100%, виявлення антиядерних антитіл визначає діагноз
- (5-25%)
- (100%)
- (30-50%)
- ювенільний ревматоїдний артрит (20-50%)
- (40-70%)
- (30-80%)
- (синдром Шарпа) 100%
- аутоімунний гепатит ( ) — 100%
- антифосфоліпідний синдром (40-50%)
- синдром Фелти (95 -100%)
2. Аутоімунні захворювання
- аутоімунний тиреоїдит (30-50%)
- (15-25%)
- цукровий діабет
3. Інфекційні захворювання — частота виявлення антинуклеарних антитіл варіює
- гострий ,
- малярія
- лепра
4. Пухлинні захворювання
- пухлинні захворювання крові — гострий і хронічний ,
5. Інші захворювання
- (30%)
- (25%)
- (15-25%)
- хвороба Рейно (20-60%)
- придбана гемолітична анемія
- інтерстиціальний фіброз легенів
При інфекційних, пухлинних захворюваннях поява антинуклеарних анітел нестійкий, з'являються при загостренні і зникають під час ремісії.
Антинуклеарні антитіла у здорових
- виявляються у 3-15% популяції
- частіше у жінок і осіб старше 65 років
- зі збільшенням віку титри антинуклеарних антитіл ростуть
- антінуклерние антитіла представлені переважно імуноглобулінами М (IgM)
- можуть з'явиться за кілька років до перших симптомів системного захворювання
Частота виявленняантинуклеарних антитіл в здоровій популяції
- 1:40 — 20-30%
- 1:80 — 10-12%
- 1: 160 — 5%
- 1: 320 — 3%